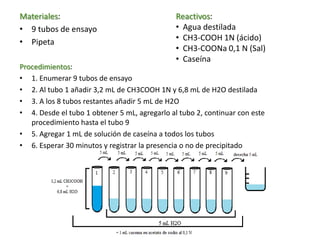
Este documento describe una serie de experimentos sobre las propiedades de las proteínas. En el primer experimento, se determinó que las proteínas en suero sanguíneo actúan como un buen amortiguador de pH. En el segundo, se encontró que el punto isoeléctrico de la caseína es de aproximadamente pH 4.7. Finalmente, se evaluó cómo diferentes iones pueden hacer precipitar a las proteínas dependiendo del pH de la solución.







![Resultados y observaciones
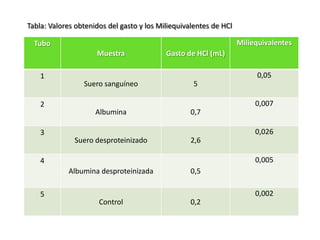
Lo primero que calcularemos serán los Miliequivalentes en cada
muestra con la siguiente formula.
Meq = [N]xV
• Tubo 1: Meq = 0,01N x 5 mL Meq = 0,05
• Tubo 2: Meq = 0,01N x 0,7 mL Meq = 0,007
• Tubo 3: Meq = 0,01N x 2,6 mL Meq = 0,026
• Tubo 4: Meq = 0,01N x 0,5 mL Meq = 0,005
• Tubo 5: Meq = 0,01N x 0,2 mL Meq = 0,002](https://image.slidesharecdn.com/laboratorion2-130731195205-phpapp02/85/Propiedades-de-las-proteinas-laboratorio-bioquimica-9-320.jpg)




![Tubo [CH3COOH] [CH3COONa] [CH3COOHxFd] pH ¿Precipita?
1 0,32 N 0,017 N 0,27 3,4
2 0,16 N 0,017 N 0,13 3,8
3 0,08 N 0,017 N 0,07 4,0
4 0,04 N 0,017 N 0,03 4,4
5 0,02 N 0,017 N 0,016 4,7 Si
6 0,01 N 0,017 N 0,00833 5,0
7 0,005 N 0,017 N 0,00417 5,3
8 0,0025 N 0,017 N 0,00208 5,6
9 0,00125 N 0,017 N 0,00104 5,9
El tubo 4 con un pH de 4,7 precipita, esto quiere decir que tiene el
PUNTO ISOELECTRICO de la caseína (se encuentra en su punto de menos solubilidad).
Tabla: precipitación de caseína en su punto isoeléctrico](https://image.slidesharecdn.com/laboratorion2-130731195205-phpapp02/85/Propiedades-de-las-proteinas-laboratorio-bioquimica-16-320.jpg)