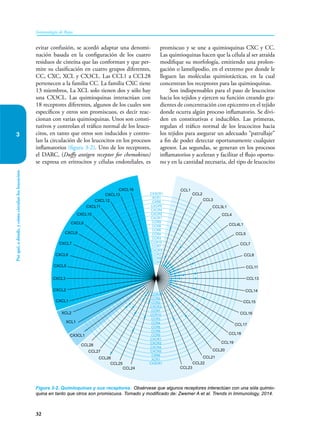
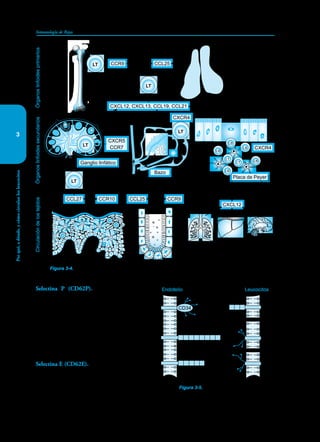
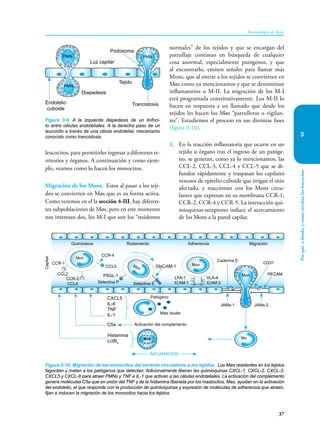
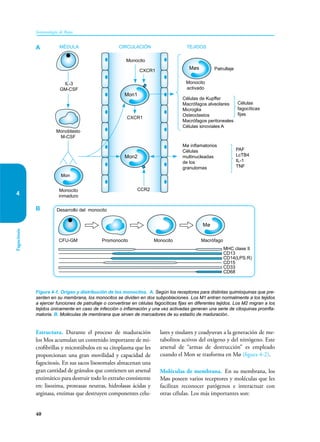
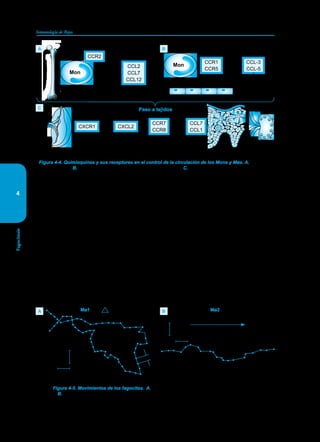
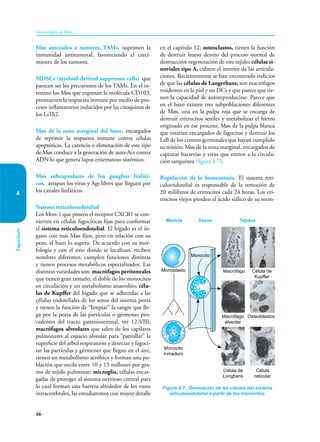
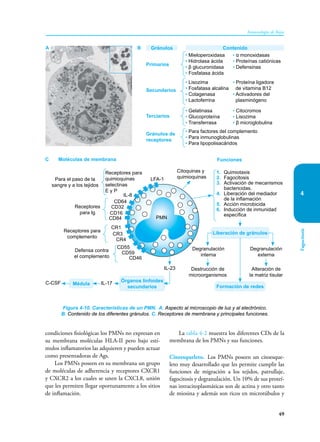
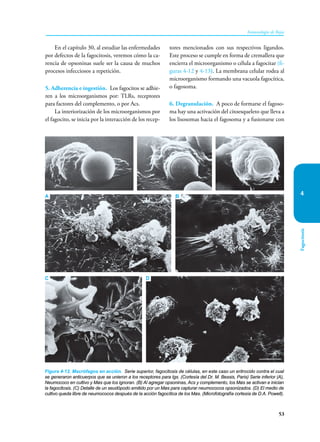
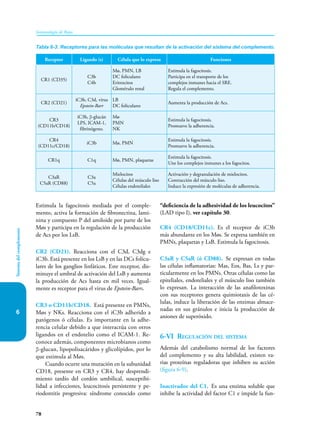
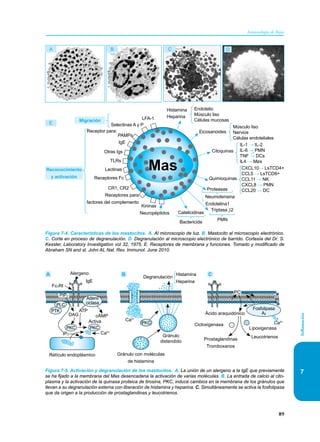
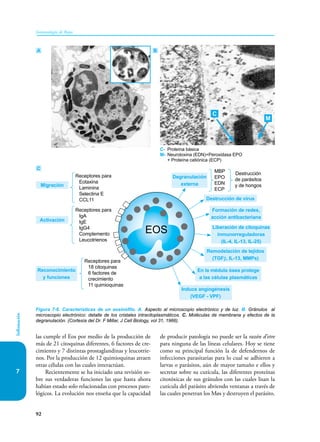
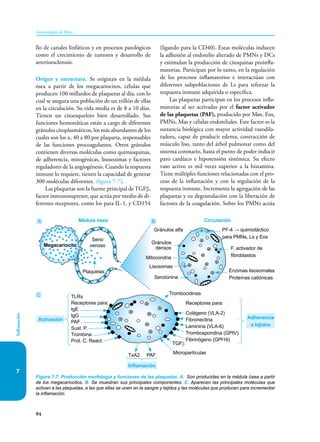
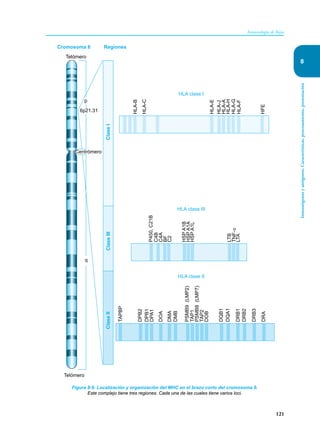
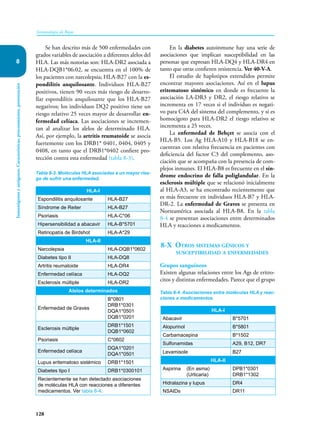
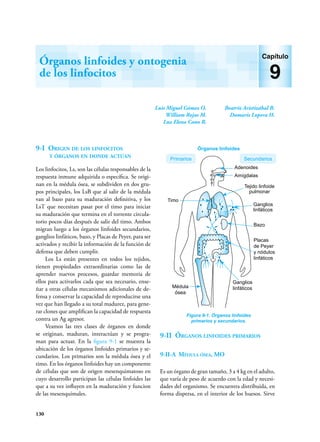
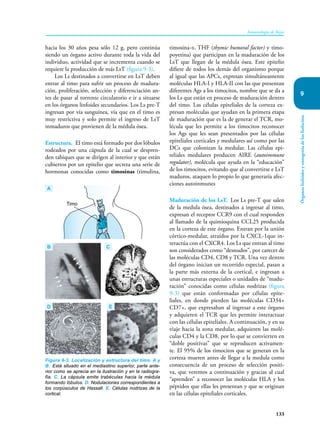
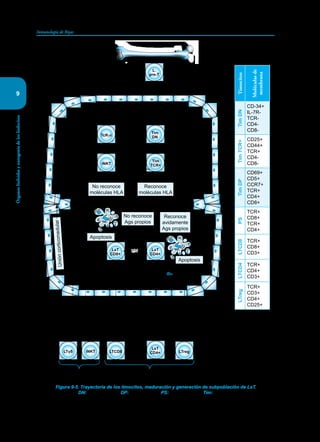
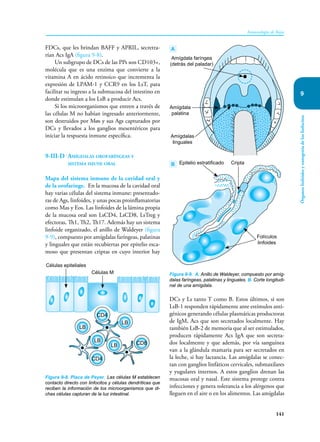
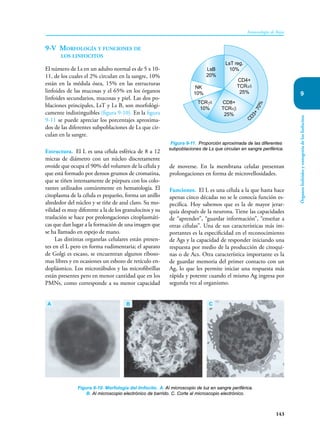
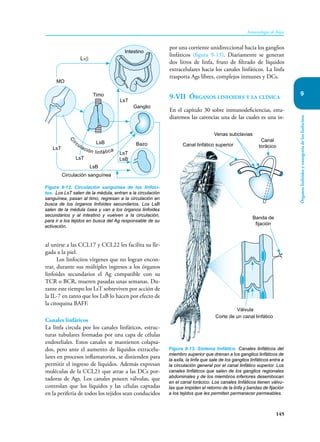
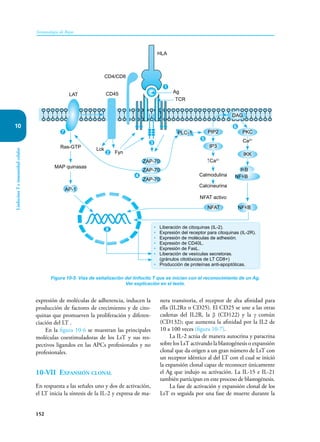
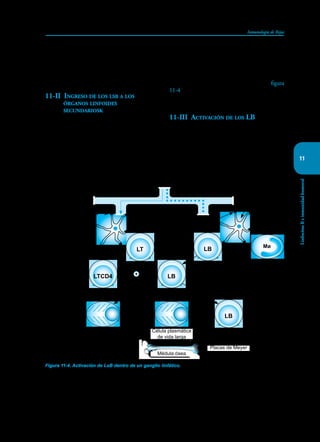
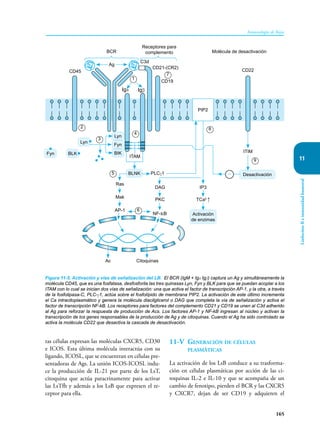
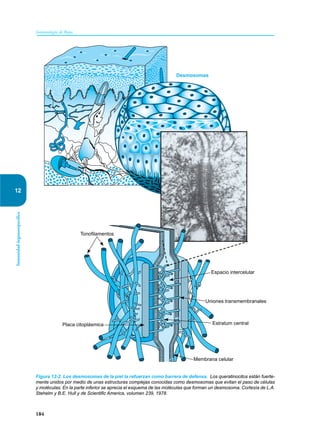
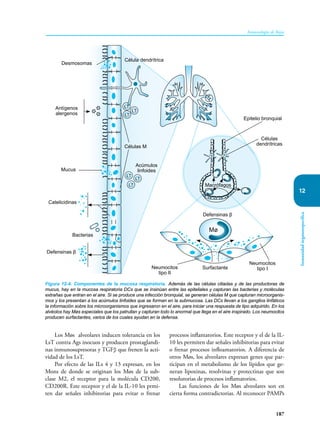
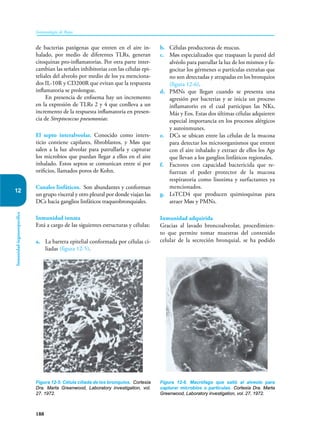
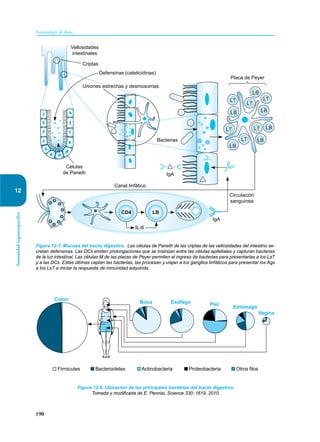
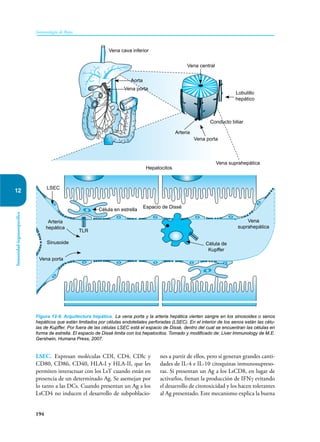
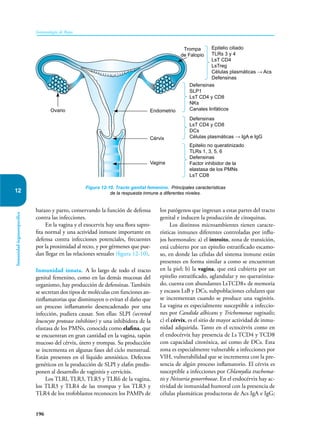
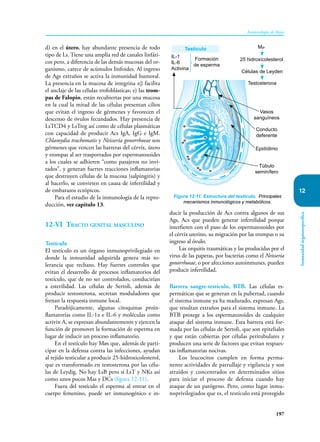
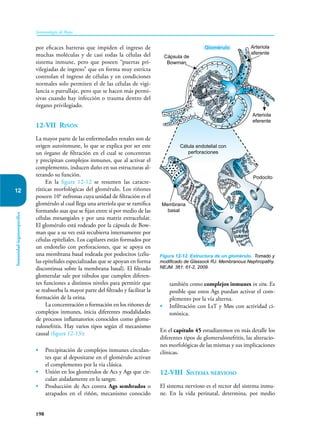
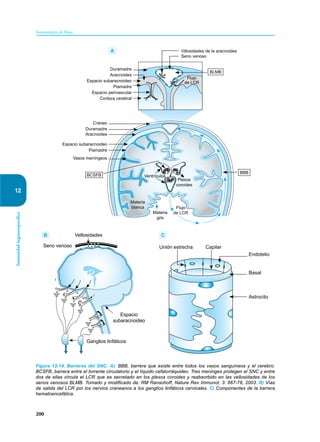
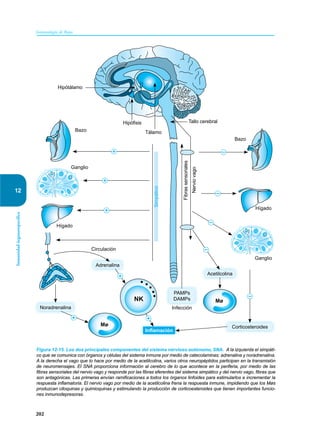
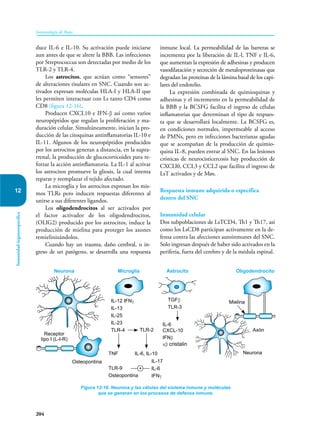
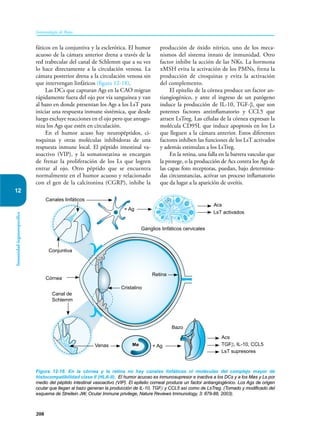
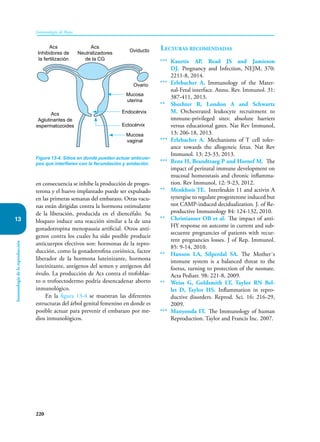
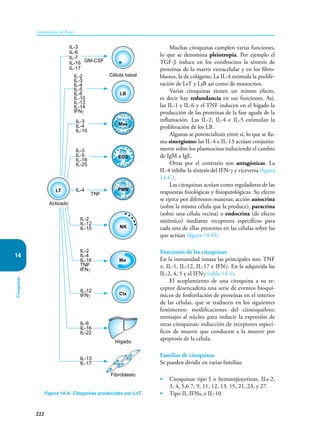
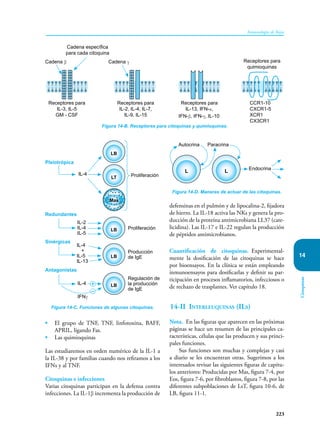
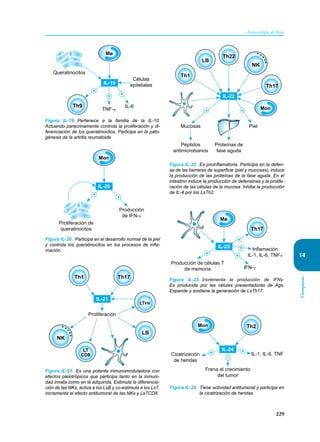
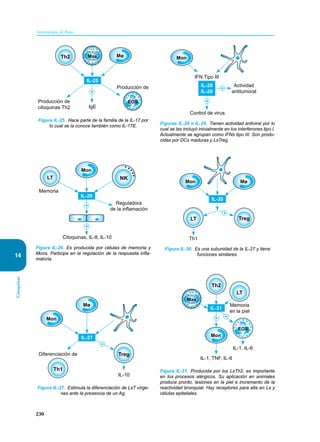
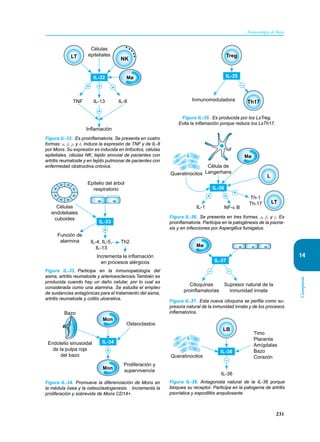
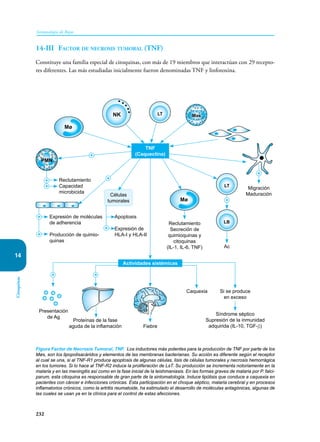
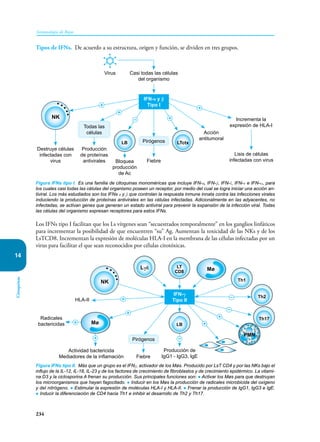
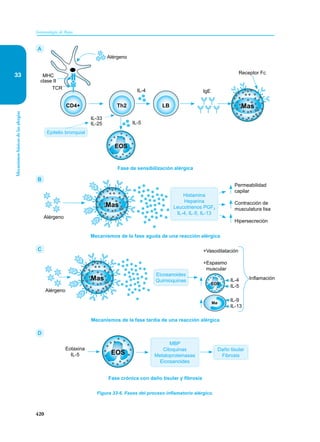
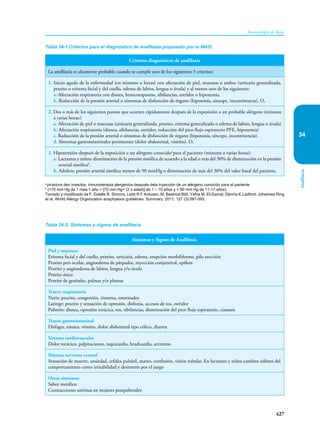
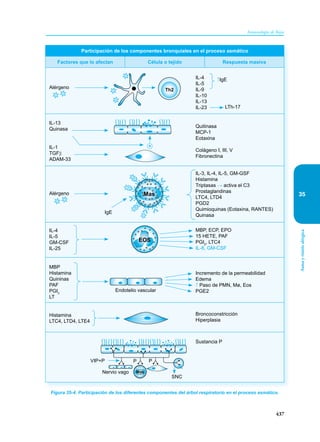
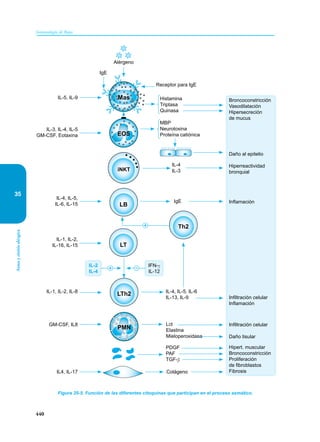
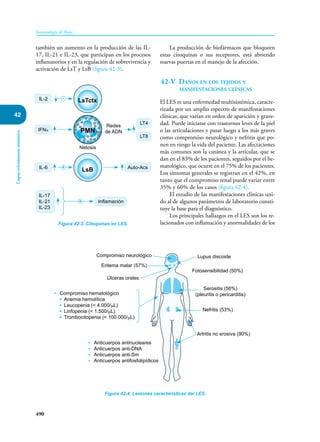
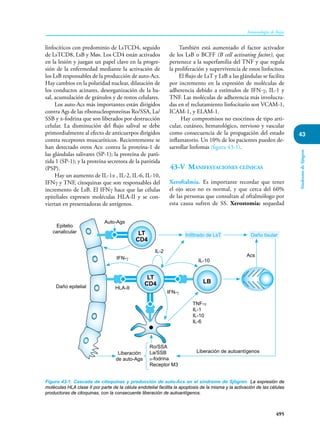
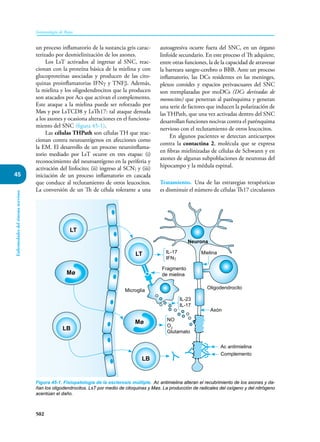
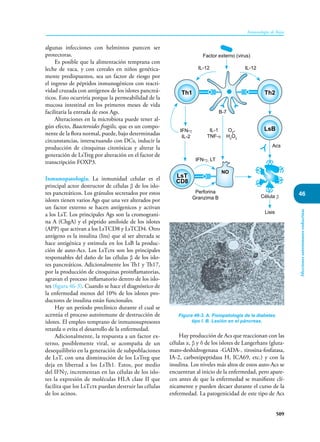
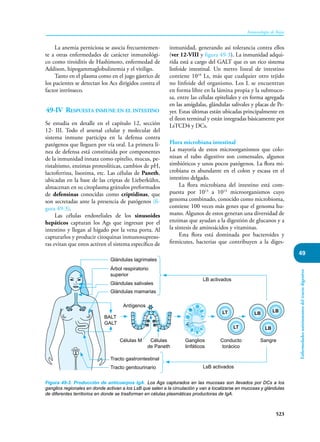
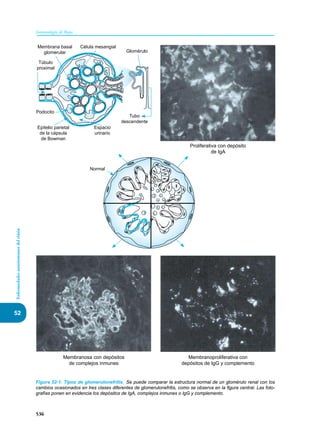
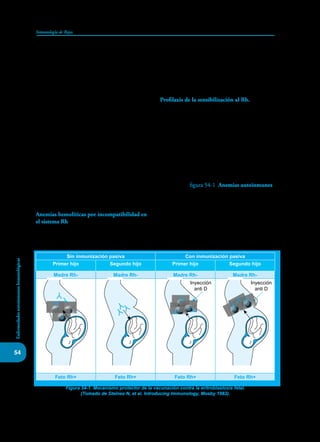
Este documento presenta un resumen del libro "Inmunología de Rojas", decimoséptima edición. El libro cubre temas básicos de inmunología como la inmunidad innata, adquirida, células y moléculas del sistema inmune, así como aplicaciones clínicas incluyendo infecciones, cáncer, alergias y enfermedades autoinmunes. El libro es una referencia importante para estudiantes e investigadores de la inmunología.