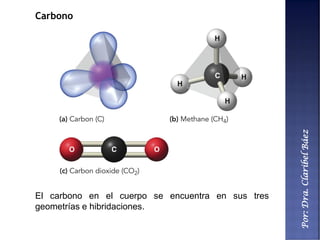
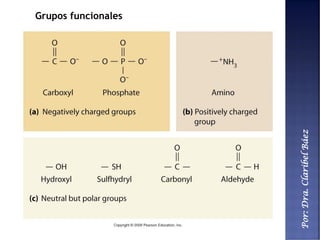
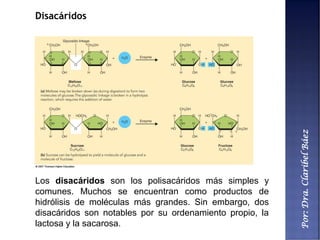
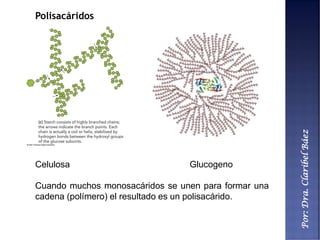
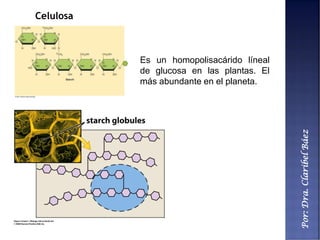
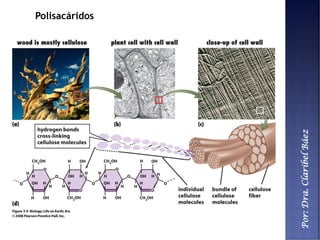
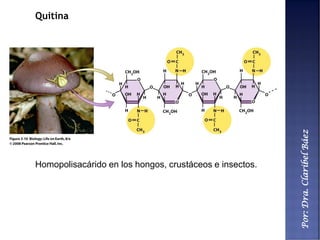
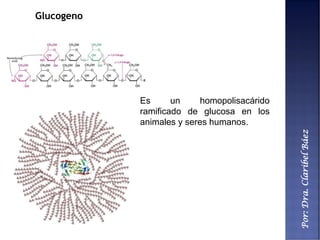
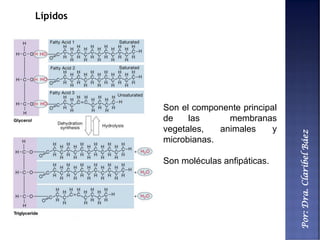
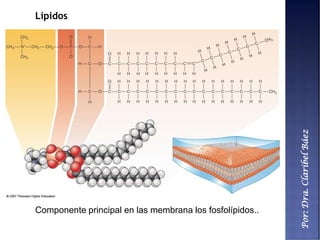
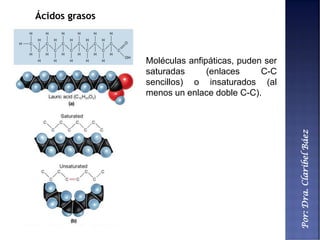
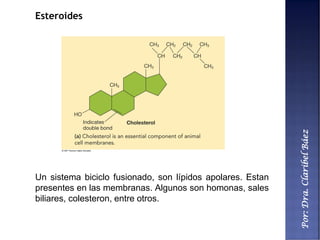
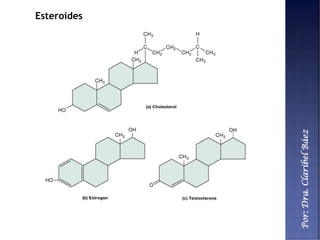
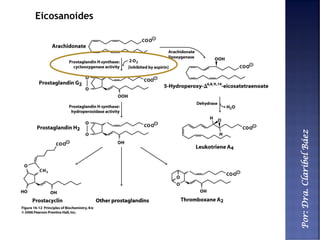
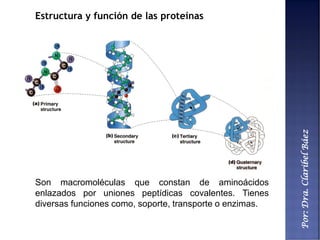
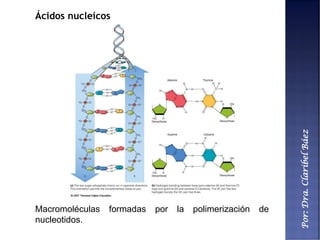
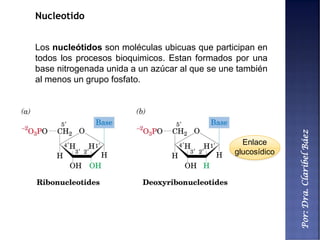
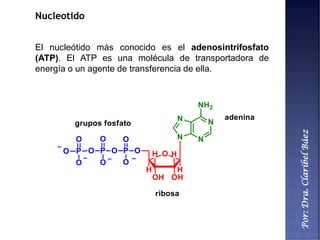
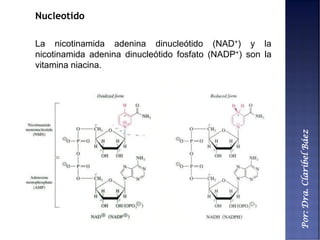
Este documento describe los principales componentes químicos del cuerpo humano. Seis elementos no metálicos, como el carbono, el oxígeno y el nitrógeno, componen más del 97% del peso del cuerpo y forman enlaces covalentes estables. Estos elementos se encuentran en moléculas como los polímeros, los monosacáridos, los lípidos, las proteínas y los ácidos nucleicos, que cumplen funciones estructurales y metabólicas importantes.





![Ionización del agua
Kw = [1 X 10-7 M ] [1 X 10-7 M ] = 1 X 10-14 M
[ H+ ] =1 X 10-7 M
Kw = [ H+ ] [OH- ] = 1 X 10-14 constante de producto iónico del agua
[ OH- ] = 1 X 10-7 M
pH = - log [H+] = 7
H2O H+ + OH
-
ácido base](https://image.slidesharecdn.com/int-180131142358/85/Int-a-biochem-y-agua-39-320.jpg)
![pH
pH = - log [H+] [H+] = 1 x 10-pH
Metros de pH](https://image.slidesharecdn.com/int-180131142358/85/Int-a-biochem-y-agua-40-320.jpg)
![Ácido y base
pH = - log [H+]
[H+] = 1 x10-pH :. [H+] = 10-pH
1. Busque el pH para los siguientes:
a) HCl 0.0001M b) HCl 0.01M c) NaOH 0.0001M
d) HCl 0.0013M e) NaOH 0.00008M
2. Busque la concentración del [H+] para los siguientes:
a) pH = 3 b) pH = 9 c) pH = 5](https://image.slidesharecdn.com/int-180131142358/85/Int-a-biochem-y-agua-42-320.jpg)
![Curvas de titulación
CH3COOH H+ + CH3CO¯
Ka = [H+] [A-]
[HA]
HA H++ A-
Ka = [H+] [CH3CO¯]
[CH3COOH]
C
O
OHC
H
H
H C
O
O¯C
H
H
H + H+](https://image.slidesharecdn.com/int-180131142358/85/Int-a-biochem-y-agua-44-320.jpg)
![Ácidos débiles
pH = pKa + log [A-]
[HA]
Henderson-Hasselbalck
Henderson-Hasselbalch- es una fórmula química que se
utiliza para calcular el pH, de una solución, a partir
del pKa (la constante de disociación del ácido) y de las
concentraciones de equilibrio del ácido o base, del ácido o la
base conjugada.
pK- es la fuerza que tienen las moléculas de disociarse (es el
logaritmo negativo de la constante de disociación ácida.](https://image.slidesharecdn.com/int-180131142358/85/Int-a-biochem-y-agua-45-320.jpg)