El documento presenta información sobre conceptos fundamentales de bioquímica como:
1) Los grupos funcionales carboxilo y los enlaces de carbono.
2) Las estructuras presentes tanto en células procariotas como eucariotas como el citoesqueleto y la membrana plasmática.
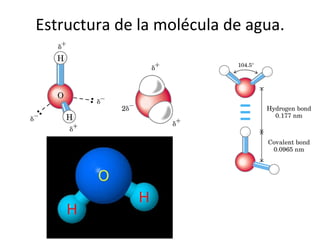
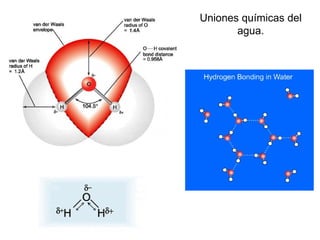
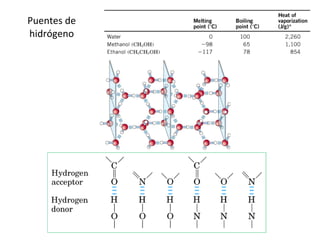
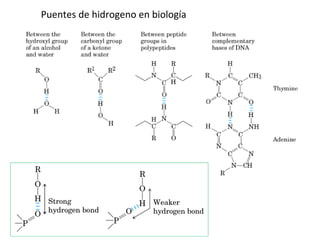
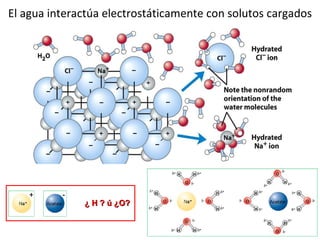
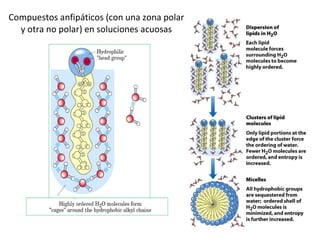
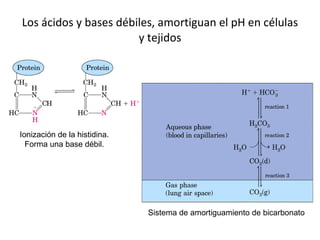
3) Las propiedades de moléculas como el agua y su capacidad para formar enlaces de hidrógeno y solubilizar otras moléculas.


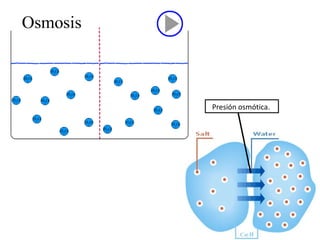

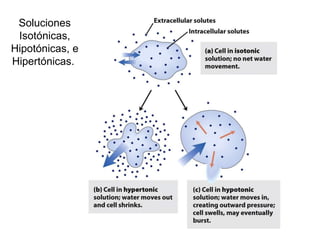

![Hipótesis Si encontramos la presión osmótica de las células en el tejido, solo tendremos que preparar una solución de sacarosa con esa misma presión osmótica. Si: Π=RT [(i 1 C 1 )+(i 2 C 2 )+…] entonces: Π tejido =RT [(i Kcl C Kcl )+ (i NaCl C NaCl )] Sabiendo que, el Peso Molecular de la sacarosa es 342: 342 *0.26= Si substituimos: Π tejido =RT [(2*0.03 mol/L)+(2*0.1 mol/L)] que es igual a: Π tejido =RT (0.26 mol/L) Dado que: Π sacarosa =Πtejido Y Π sacarosa =RT (0.26 mol/L) Ya que las dos se multiplican por RT, podemos quitar este termino. Π sacarosa =0.26 mol/L 88.92 g/L](https://image.slidesharecdn.com/aguaacidosybses-110807224955-phpapp01/85/Agua-acidos-y-bases-13-320.jpg)

![Ionización del agua H 2 O H + + OH - [H + ][OH - ] K eq = [H 2 O]](https://image.slidesharecdn.com/aguaacidosybses-110807224955-phpapp01/85/Agua-acidos-y-bases-16-320.jpg)
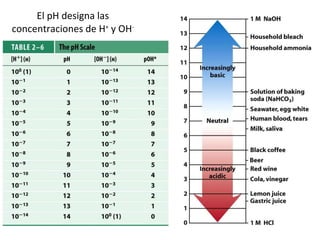
![Producto iónico del agua [H + ][OH - ] K eq = [H 2 O] K eq [H 2 O] = [H + ][OH - ]= 1 x 10 -14 [H + ] y [OH - ] es de 1 x 10 -7 M , cada uno. 1 x 10 -7 M = -log (0.0000001 M)= 7](https://image.slidesharecdn.com/aguaacidosybses-110807224955-phpapp01/85/Agua-acidos-y-bases-17-320.jpg)
![-log = p pH = -log [H + ]](https://image.slidesharecdn.com/aguaacidosybses-110807224955-phpapp01/85/Agua-acidos-y-bases-18-320.jpg)
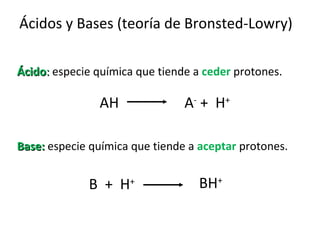
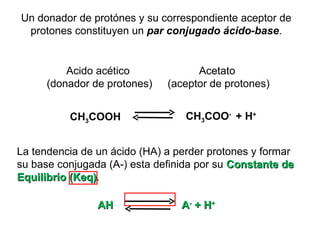
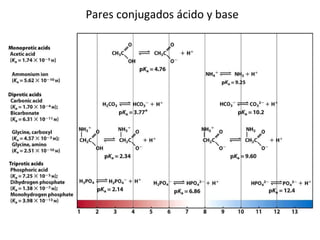
![Constantes de disociación de ácidos y bases débiles Keq = = Ka [A - ] [H + ] [AH] AH A - + H +](https://image.slidesharecdn.com/aguaacidosybses-110807224955-phpapp01/85/Agua-acidos-y-bases-22-320.jpg)
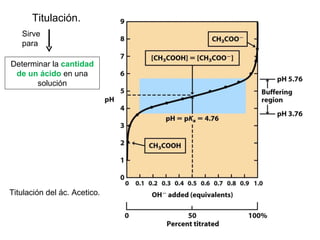
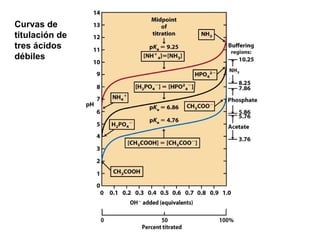

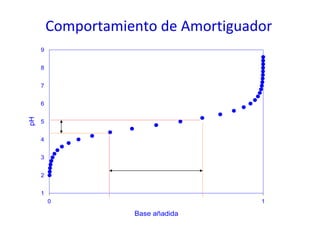
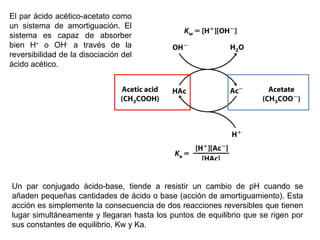
![Ecuación Henderson-Hasselbalch, relaciona el pH con el pKa y con la concentración de amortiguador Ecuación Henderson-Hasselbalch Curva de titulación Descrita por Ka = [A - ] [H + ] [AH] [H + ]= K a + [A - ] [AH] log [H + ]= log K a + log [A - ] [AH] -log [H + ]= -log K a + log [A - ] [AH] pH = pK a + log [base] [ácido]](https://image.slidesharecdn.com/aguaacidosybses-110807224955-phpapp01/85/Agua-acidos-y-bases-29-320.jpg)
![En resumen El agua pura se ioniza ligeramente, formando un número igual de iones de H y los iones OH. El grado de ionización es descrito por una constante de equilibrio, Keq. El producto iónico del agua, Kw, es igual a [H] [OH]= 1 X 10 -14 El pH refleja, en una escala logarítmica, la concentración de iones de hidrógeno. Cuanto mayor es la acidez de una solución, más bajo su pH. Los ácidos débiles se ionizan parcialmente para liberar iones de hidrógeno, lo que disminuye el pH de la solución. Bases débiles aceptar iones de hidrógeno, aumentando el pH. La extensión de estos procesos es característica de cada par ácido-base y se expresa como una constante de disociación, Ka. El pKa expresa, en una escala logarítmica, la fuerza relativa de un ácido o base débil Cuanto más fuerte sea el ácido, menor es su pKa. Mientras mas fuerte es la base, mayor es su pKa. El pKa puede determinarse experimentalmente, es el pH en el punto medio de la curva titulación de un ácido o base.](https://image.slidesharecdn.com/aguaacidosybses-110807224955-phpapp01/85/Agua-acidos-y-bases-32-320.jpg)