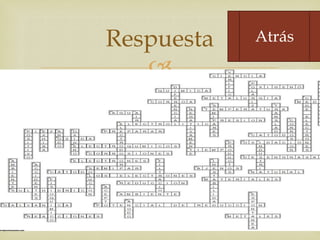
La estudiante presenta un proyecto sobre cómo evitar la corrosión de los metales. El proyecto incluye una introducción sobre la corrosión y sus causas, una hipótesis sobre posibles formas de evitarla, y detalles sobre experimentos planeados para probar diferentes métodos.