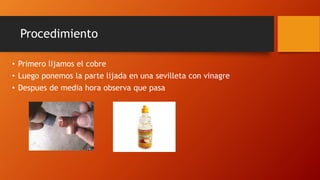
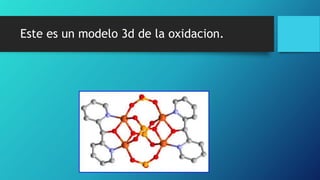
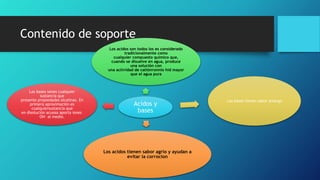
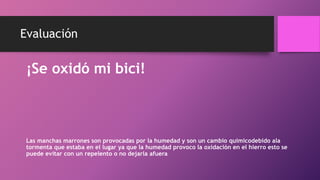
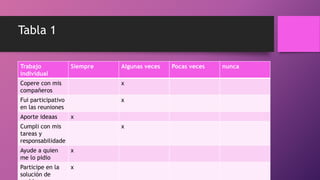
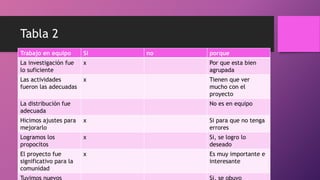
Este documento trata sobre la corrosión y oxidación de los metales. Explica que la corrosión es el deterioro de un material por un ataque electroquímico de su entorno y que ocurre por una reacción de oxidación-reducción. Además, menciona que a nivel mundial se disuelven 5 toneladas de acero cada pocos segundos debido a este fenómeno. Finalmente, enumera diferentes métodos para controlar la corrosión como la eliminación de elementos corrosivos, el uso de inhibidores químicos y la protección eléct