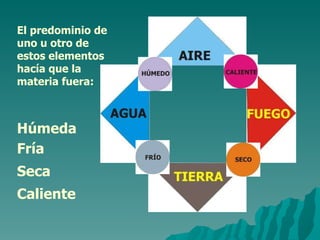
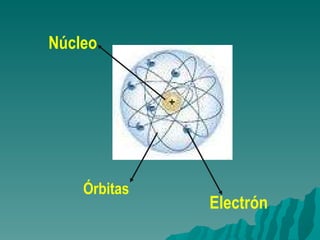
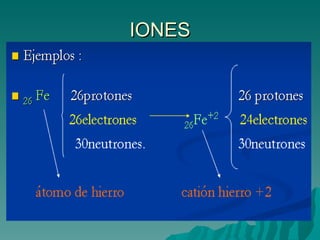
El documento resume la evolución del entendimiento de la materia a través de la historia, desde las primeras teorías de los griegos hasta el modelo atómico moderno. Demócrito propuso que la materia está compuesta de átomos indivisibles, una idea retomada por Dalton siglos después. Luego, se descubrió que los átomos pueden dividirse en partículas subatómicas como protones, neutrones y electrones. Actualmente, la teoría cuántica explica que los electrones se comportan como ondas alrededor del n