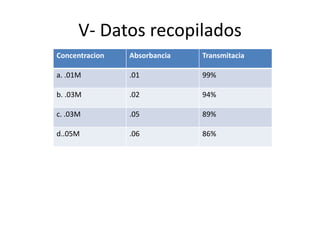
El documento describe un laboratorio de química sobre la clasificación de disolventes y solutos, utilizando sulfato de cobre y un espectrofotómetro. A través de experimentos, se midieron absorbancia y transmitancia para diferentes concentraciones de la solución, concluyendo que la absorción de luz depende de la concentración de la sustancia. Se analizan también factores que pueden afectar la precisión de las mediciones y se explican conceptos clave como molaridad y la relación entre transmitancia y absorbancia.