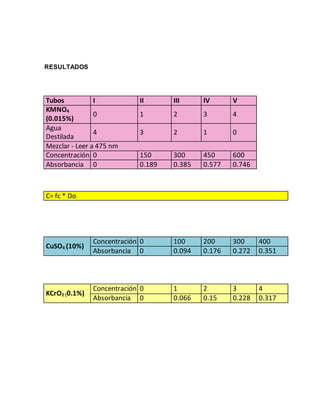
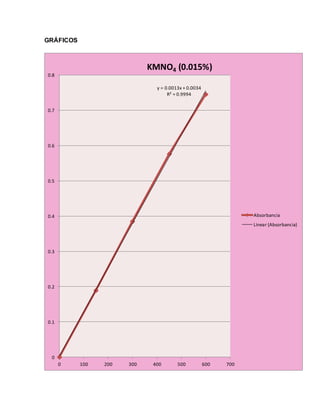
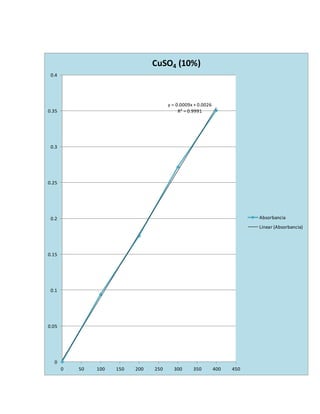
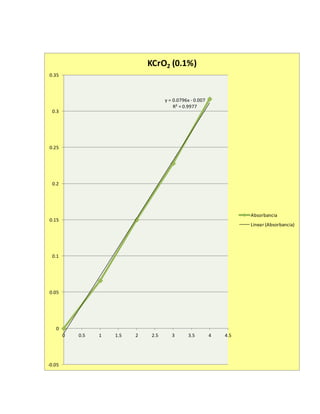
Este documento presenta un experimento sobre espectrofotometría. El objetivo era conocer cómo usar un espectrofotómetro y analizar datos. Se midió la absorbancia de varias soluciones a diferentes longitudes de onda y concentraciones. Los resultados se graficaron y ajustaron con la ley de Beer-Lambert para determinar las concentraciones óptimas.