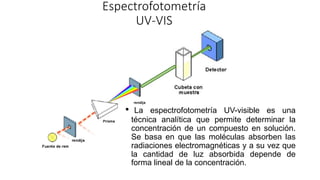
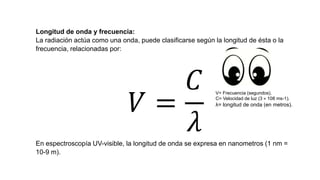
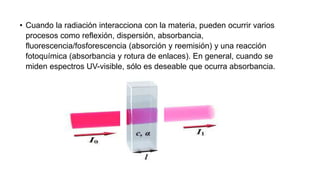
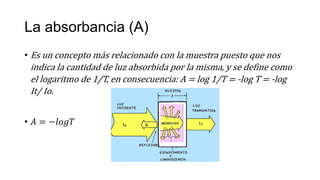
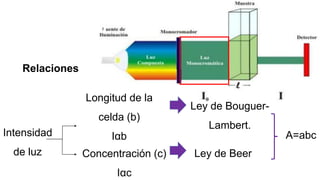
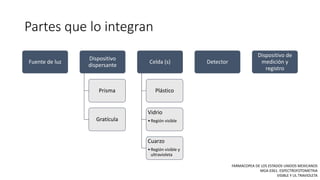
La espectrofotometría UV-Vis es una técnica que mide la concentración de compuestos en solución a través de la absorción de radiaciones electromagnéticas. Se basa en principios como la ley de Beer-Lambert, que relaciona la absorbancia con la concentración y la ruta óptica, y permite la identificación y cuantificación de sustancias. Este documento también aborda la teoría detrás de la técnica, su aplicación práctica en problemas de análisis químico y referencias bibliográficas relevantes.