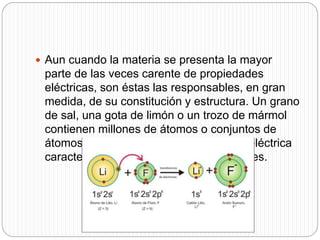
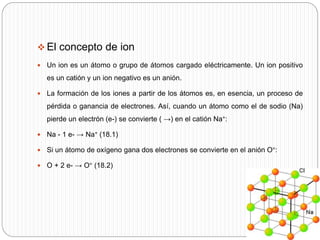
Este documento trata sobre los iones. Explica que los iones son partículas con carga eléctrica que participan en reacciones químicas y forman estructuras cristalinas ordenadas. Define un ion como un átomo o grupo de átomos cargados eléctricamente a través de la ganancia o pérdida de electrones. Además, describe las fuerzas de enlace iónico y cómo se forman los iones metálicos y no metálicos a través de la ionización y afinidad electrónica.