Este documento presenta la composición y funciones del Consejo Nacional de Vacunación de México, el cual está conformado por autoridades de salud y especialistas. Su objetivo es establecer la política nacional de vacunación y asegurar su adecuada aplicación.





























































![64
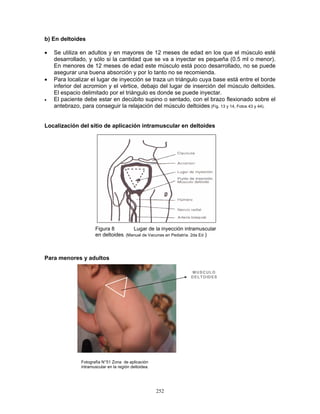
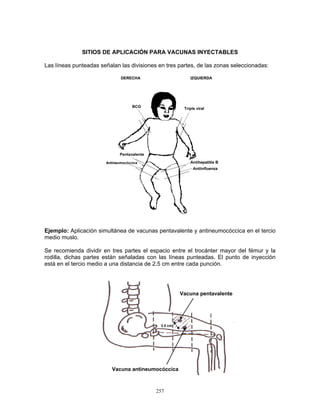
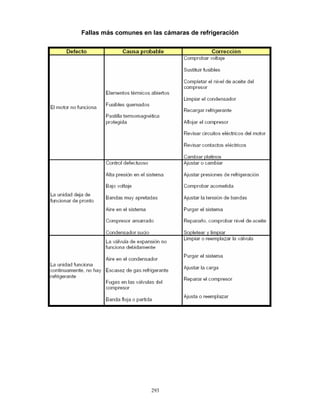
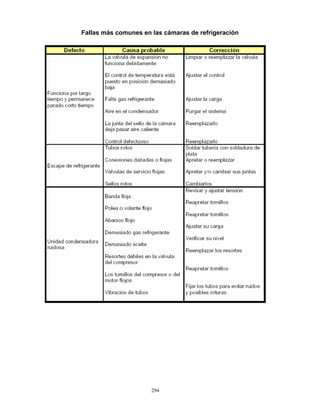
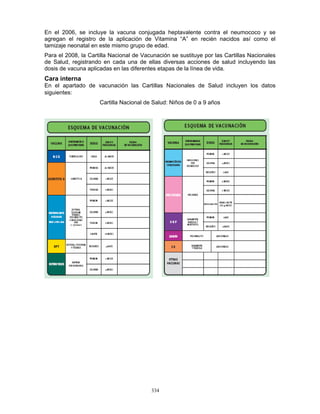
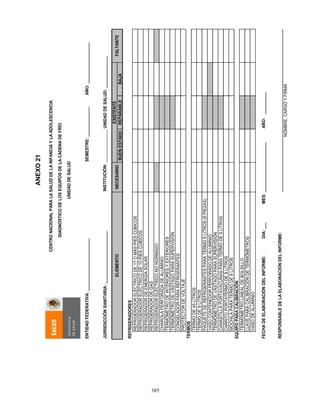
3. Conservación
Las vacunas se almacenan y se conserva de 2 a 8 °C en el refrigerador y de 4 a 8°C en el
termo, para su aplicación en unidades de salud o en campo. Para el caso de la vacuna
monovalente, previo a su aplicación se deberá verificar que tanto la vacuna como el
diluyente mantengan la temperatura señalada, la vacuna debe reconstituirse
inmediatamente antes de ser aplicada. Para la vacuna pentavalente, se recomienda
conservar el tubo dosificador en el embalaje exterior para protegerlo de la luz.
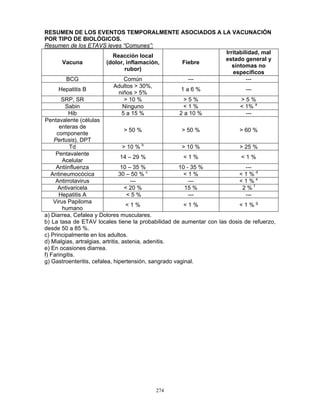
4. Eficacia
Vacuna antirrotavirus con serotipo G1P1
Eficacia contra diarrea por cualquier serotipo de rotavirus
Después de la aplicación de la primera dosis, la vacuna ya es eficaz en el 81.1% para
evitar enfermedad severa, y después de la segunda dosis aumenta a un 84.7%; la eficacia
para enfermedad de gravedad extrema (≥19 puntos en la escala de Ruuska y Vesikari)
fue el 100%; y se alcanzó una eficacia del 85% para evitar hospitalizaciones por diarrea.
Eficacia específica de serotipo
Cuando se evaluó la eficacia (de acuerdo a la escala de Vesikari) contra el serotipo
homólogo, G1P[8], ésta fue del 90.8%, la eficacia contra serotipos que pertenecen al
mismo genogrupo G3P[8], G4P[8] y G9P[8] fue del 87.3%. En el caso del serotipo G2P[4]
que pertenece a distinto genogrupo, la eficacia fue del 41%.
Vacuna antirrotavirus pentavalente
La eficacia protectora de esta vacuna fue evaluada de dos formas en un ensayo clínico
controlado con placebo de eficacia y seguridad contra rotavirus con los siguientes
resultados:
Reducción en la incidencia de gastroenteritis por rotavirus durante una temporada
completa después de la vacunación:
• 98% de eficacia contra gastroenteritis grave (duración de los síntomas) causada
por rotavirus para los serotipos G1, G2, G3 y G4.
• 74% de eficacia contra cualquier gravedad de gastroenteritis causada por rotavirus
para los serotipos G1, G2, G3 y G4.
Reducción en hospitalizaciones/visitas a los servicios de urgencias por gastroenteritis
causada por rotavirus hasta 2 años después de la vacunación:
• 96% de reducción en hospitalizaciones debido a gastroenteritis causada por
rotavirus.
• 94% de reducción de visitas al servicio de urgencia por gastroenteritis causada
por rotavirus.
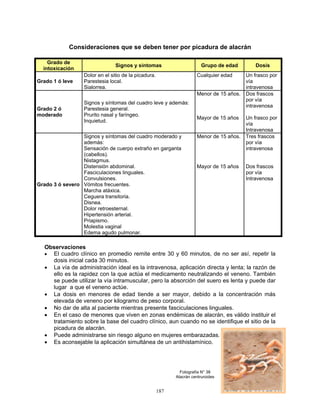
5. Indicaciones
Inmunización activa contra gastroenteritis causada por rotavirus.
6. Contraindicaciones
• Hipersensibilidad conocida a la aplicación previa de la vacuna.
• Sujetos con antecedente de enfermedad gastrointestinal crónica, incluyendo
cualquier malformación congénita no corregida](https://image.slidesharecdn.com/manualva-130627220728-phpapp02/85/Manual-va-64-320.jpg)











































































![141
BIBLIOGRAFÍA
1. C.D.C.Quadrivalent Human Papillomavirus Vaccine.Recommendations of the Advisory
Committee on Immunization Practices (ACIP) March 23, 2007 / 56(RR02);1-24 .
2. CDC. Virus del papiloma humano: Información sobre el VPH para los médicos. Agosto del
2007.
3. CDC. Quadrivalent Human Papillomavirus Vaccine. Recommendations of the Advisory
Committee on Immunization Practices (ACIP). March 23, 2007 / Vol. 56 / RR-2.
4. Gómez García, E. Gómez Mampaso, S. Conde Someso, E. Maganto Pavón, S. Navío Niño, A.
Allona Almagro. Infección por Papillomavirus en el hombre. Estado actual. Actas Urol Esp.
Vol.29 no.4 Madrid. Apr. 2005.
5. Glaxo Smith Kline. Ficha Técnica, Resumen de las Características del Producto.
6. Merc&com.GARDASIL®. [Human Papillomavirus Quadrivalent (Types 6, 11, 16, and 18)
Vaccine, Recombinant]. Julio 2007.
7. Rachel L. Winer, Shu-Kuang Lee, James P. Hughes, Diane E. Adam, Nancy B. Kiviat and
Laura A. Koutsky. Genital Human Papillomavirus Infection: Incidence and Risk Factors in a
Cohort of Female University Students. Am J Epidemiol 2003; 157:218-226.
8. Secretaría de Salud. Lineamientos para la aplicación de vacunas contra infección del Virus del
Papiloma Humano, en el Sector Privado.
Página Web: http://www.cancer.gov/espanol/cancer/hojas-informativas/vacuna-VPH-respuestas
http://www.farmaciasahumada.cl/stores/fasa/html/Mft/PRODUCTO/P7917.HTM](https://image.slidesharecdn.com/manualva-130627220728-phpapp02/85/Manual-va-141-320.jpg)





















![163
BIBLIOGRAFÍA
1. Almeida GL, Franco PC, Pérez LF, Santos PI. Enfermedad por meningococo, Neisseria
meningitidis: perspectiva epidemiológica, clínica y preventiva. Salud Pública de México
2004;46:438-50.
2. Aventis Pasteur. Meningococcal (grupo A, C, Y and W-135) polisaccharide difteria toxoid
conjugate vaccine: Menactra [drug insert]. Swift-water, PA: Aventis Pasteur, Inc. 2005.
3. Center for Disease control and prevention. Case definitions for infectious conditions under
public health surveillance. MMWR 1997¸46(RR-10) 156.
4. Coria-Lorenzo JJ, Morales-Aguilar JJ, Guerrero CG. Vacuna contra meningococo. In Coria-
Lorenzo JJ. Enfermedades Prevenibles por Vacunación en Pediatria. Manual Ilustrado. 1
ra
Ed. México: M&M; 2007. p .81-92.
5. Granoff DM, Feavers IM, Borrow R. Meningococcal vacin. In: Plotkin SA, Orenstein WA,
eds. Vaccines. 4th
ed. Philadelphia: Saunders, 2004: 959-87.
6. Kohl S. Vacuna conjugada contra meningococo. Vacunación Hoy 2007; 14(84):189-93.
7. MMWR. Prevention and Control of Meningococcal Disease. Recommendations of the
Advisory Committee on Immunization Practices (ACIP) MMWR. May 25, 2005; 54
(RR07):1-21.
8. Morley SL, Pollard AJ. Vaccine prevention of meningococcal disease,. Coming soon?
Vaccine 2002;20:666-687.
9. Neal KR, Nguyen –Van-Tam JS, Jeffrey N, Slack RCB, Madeley RI, Ait-Tahar K et al.
Changing carriage rate of Neisseria meningitides among university students during the first
week of term: Croos sectional study. BMJ 2000; 320:846-849.
10. Novelli VM, Lewis RG, Dawood ST. Epidemic group A meningococcal disease in Haj
pilgrims. Lancet 1987;2(8563):863.
11. Pace D, Pollard JA. Meningococcal A, C Y and W-135 polysaccharide-protein conjugates
vaccines. Arch Dis Child 2007; 92:909-915.
12. Rosenstenin NE, Perkons BA, Stephens DS, Popovic T, Hughes IM. Meningicocca disease.
N. Engl Med 2003, 344(18):1378-1388.
13. Schawartz B, Moore PS, Broome CV. Global epidemiology of meningococcal disease. Clin
Micribiol Rev 1989; 2 suppl: S118-S124.
14. Stephens DS. Uncloaking the meningococcus: Dynamics of carriage and disease. Lancet
1999;353:941-942.
15. Taha MK, Achtman M, Alonso JM, et al. Serogroup W135 meningococcal disease in Hajj
pilgrims. Lancet 2000;356(9248):2159.](https://image.slidesharecdn.com/manualva-130627220728-phpapp02/85/Manual-va-163-320.jpg)











































































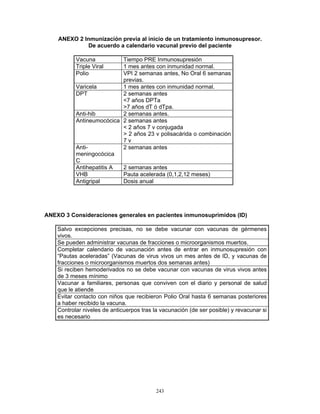


![246
BIBLIOGRAFÍA
1. Wintrobe's Clinical Hematology, John P. Greer, John Forester, John N. Luckens, 11th
Edition,
2003, Lippincott, Williams & Wilkins.
2. Principles and Practice of Pediatic Oncology, Philip A. Pizzo, David G. Poplack, 5th Edition,
2003, Lippincott, Williams & Wilkins.
3. Nathan and Oski’s Hematology of Infancy and Childhood, David G. Nathan, Stuart H. Orkin, A.
Thomas Look, David Ginsburg, 6th
Edition, 2003, Elsevier.
4. Siber GR, Weitzman SA, Aisenberg AC. Antibody response of patients with Hodgkin's disease
to protein and polysaccharide antigens. Rev. Infect. Dis. 1981;3[Suppl];S144–S159.
5. Ridgway P, Wolff LJ, Deforest A. Immunization response varies with intensity of acute
lymphoblastic leukemia therapy. Am J Dis Child 1991;145:887–891.
6. Arrowood JR, Hayney MS. Immunization recommendations for adults with cancer. Ann
Pharmacother 2002;36(7–8):1219–1229.
7. David P., Jacobson R., Current adult and pediatric vaccine recommendations. Infect Med
18(8s): FV6-FV14, 2001.
8. Gish R.G., Gadano A.C., Chronic Hepatitis B: Current Epidemiology in the Americas and
Implications for management. J Viral Hepat., 2006;13(12):787-798.
9. Bordetella pertussis, still here: options of control, Presenter: Kathryn Edwards, MD, Date
Presented: 14 Sep 2005 Date Added: 27 Jan 2006, event Type: Le Bonheur Seminars.
10. López-Gaytán E., Chávez-Gallegos S., Cruz-Borja P., Martínez_Alcázar M MA, Vacunación en
niños con cáncer. Vacunación Hoy, marzo-abril 2006, 13(76):123-126.
11. Dignani MC, Aspectos de vacunación en el paciente transplantado y oncohematológico,
Vacunación Hoy, mayo-junio 2007, 14(83):137-142.
12. Parkkali T., et.al., Tetravalent meningococcal polisaccharide is immunogenic in adult allogeneic
BMT recipients, Bone Marrow Transplantation, (2001) 21, 79-84
13. Ljungman P, et.al. Immunizations after bone marrow transplantation: results of a European
survey and recommendations from the infectious diseases working party of the European
Group for Blood and Marrow Transplantation, Bone Marrow Transplantation, (1995) Mar 15(3),
455-60
14. Machado CM, Reimmunization after bone marrow transplantation, current recommendations
and perspectives. Brazilian Journal of Medical Biological Research (2004) 37:151-158
15. Graubner U.B., Liese J., Belohradsky B. H., Impfungen(Vaccination), Klin Padiatr. 2001; 213
Suppl 1:A77-83](https://image.slidesharecdn.com/manualva-130627220728-phpapp02/85/Manual-va-246-320.jpg)





































































































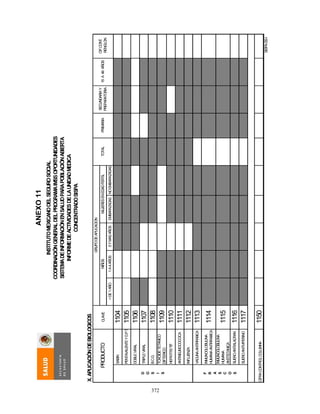





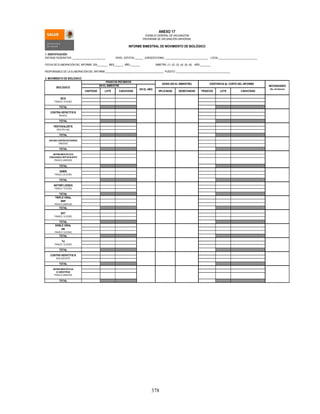




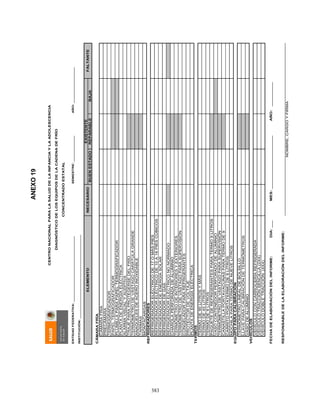
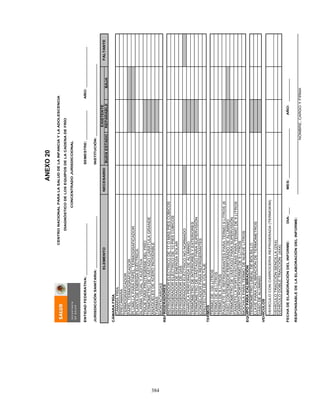



















![407
Kumate J, Gutiérrez G, Muñoz O, Santos Preciado JI. Manual de infectología clínica. 15a
edición. México, DF: Méndez Editores, 1998.
Laboratorios Pasteur Mériux Connaugt. Vacuna Stamaril Pasteur. Instructivo de uso de la
vacuna Stamaril Pasteur. Rev. 1097.
Lagos R, Levine OS, Avendaño A, Horwitz I, Levine MM. The introduction of routine
Haemmophilus influenzae type b conjugate vaccine in Chile: A framework for evaluating
new vaccines in newly industrializing countries. Pediatr Infect Dis J 1998;17:139 -148.
Macías-Parra M. Inmunizaciones. 2ª edición. México, DF: Editorial McGraw-Hill
Interamericana, 2001:5-31.
Markowitz LE, Sepúlveda AJ, Díaz-Ortega JL, Valdespino JL, Albrech P, Zell E et al.
Immunization of six-month-old infants with different doses of Edmonston-Zagreb and
Schwarz measles vaccines. N Engl J Med 1990;322:580-587.
Merc&com.GARDASIL®.[Human Papillomavirus Quadrivalent (Types 6, 11, 16, and 18)
Vaccine,Recombinant]. Julio 2007.
Mulholland K, Hilton S, Adegbola R, Ulsen S, Oparaugo A, Omosigho C et al. Randomised
trial of Haemophilus influenzae type-b tetanus protein conjugate for prevention of
pneumonia and meningitis in Gambian infants. Lancet 1997;349:1191-1197.
Organización Panamericana de la Salud. Manual para el control de las enfermedades
transmisibles. 16ª edición. Washington, DC: OPS, 1997; Publicación Científica No. 564.
Organización Panamericana de la Salud. Programa Ampliado de Inmunizaciones. Curso
básico de refrigeración para supervisores de la cadena de frío. Washington, DC: OPS,
1986.
Organización Panamericana de la Salud. Técnicas de mantenimiento y reparación de
equipos de refrigeración para la conservación de las vacunas del PAI. Washington, DC:
OPS, 1986.
Organización Panamericana de la Salud/Organización Mundial de la Salud. Importancia
de la cadena de frío en el almacenamiento y distribución de vacunas. Washington, DC:
OPS/OMS, 1987.
Pacheco CR, Vázquez-Rinza V, Badillo N. Vacuna del bacilo de Calmette y Guerin
(BCG). En: Escobar-Gutiérrez A, Valdespino-Gómez JL, Sepúlveda-Amor J. Vacunas,
Ciencia y Salud. México, DF: Secretaría de Salud, 1992:187-201.
Plotkin SA, Orenstein WA. Vaccines. 3thd
Edition. Programa Ampliado de
Inmunizaciones,1986. Técnicas de mantenimiento y reparación de equipos de
refrigeración para la conservación de las vacunas. Philadelphia (PA): WB Saunders Co.,
1999.
Rachel L. Winer, Shu-Kuang Lee, James P. Hughes, Diane E. Adam, Nancy B. Kiviat and
Laura A. Koutsky. Genital Human Papillomavirus Infection: Incidence and Risk Factors in
a Cohort of Female University Students . Am J Epidemiol 2003; 157:218-226.](https://image.slidesharecdn.com/manualva-130627220728-phpapp02/85/Manual-va-407-320.jpg)

