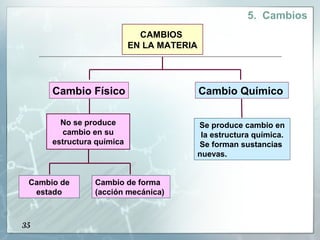
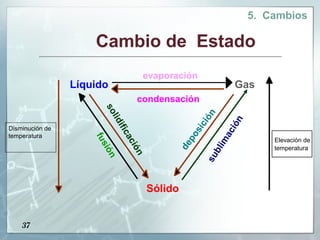
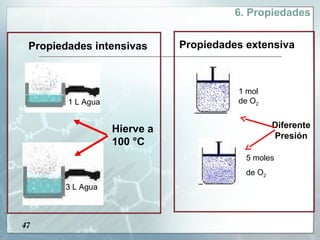
Este documento presenta una introducción a la materia. Define la materia como todo aquello que tiene masa y ocupa un espacio. Explica que la materia puede clasificarse como sustancias puras o mezclas. Las sustancias puras pueden ser elementos o compuestos, mientras que las mezclas pueden ser homogéneas u heterogéneas. También describe métodos para separar diferentes tipos de materia, como métodos físicos, químicos y reacciones nucleares. Finalmente, introduce los tres estados físicos principales de la materia: