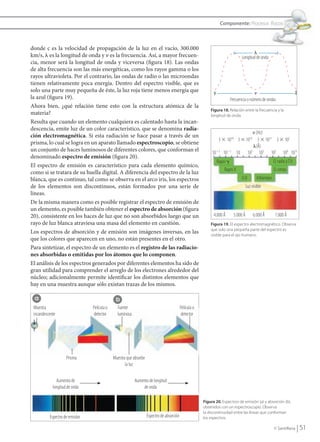
El documento describe la evolución del modelo atómico, desde la teoría ondulatoria de la luz hasta el modelo mecánico-cuántico actual. Explica cómo los espectros de emisión y absorción llevaron a Planck a proponer la teoría cuántica de que la energía se emite y absorbe en cantidades discretas llamadas cuantos. Posteriormente, Bohr aplicó esta teoría al átomo de hidrógeno proponiendo que los electrones orbitan en niveles cuánticos estacionarios. Más adelante