Incrustar presentación
Descargado 591 veces

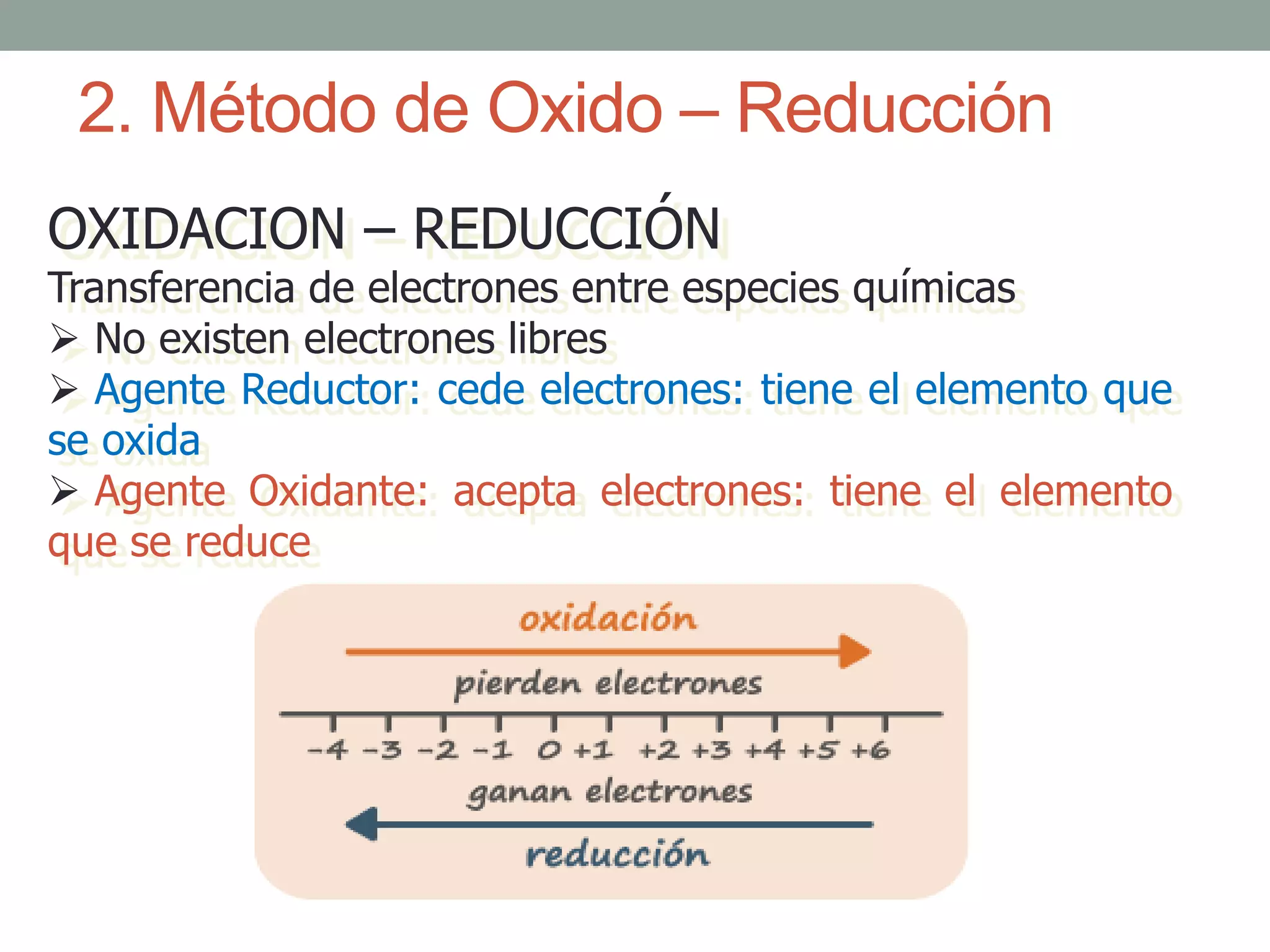
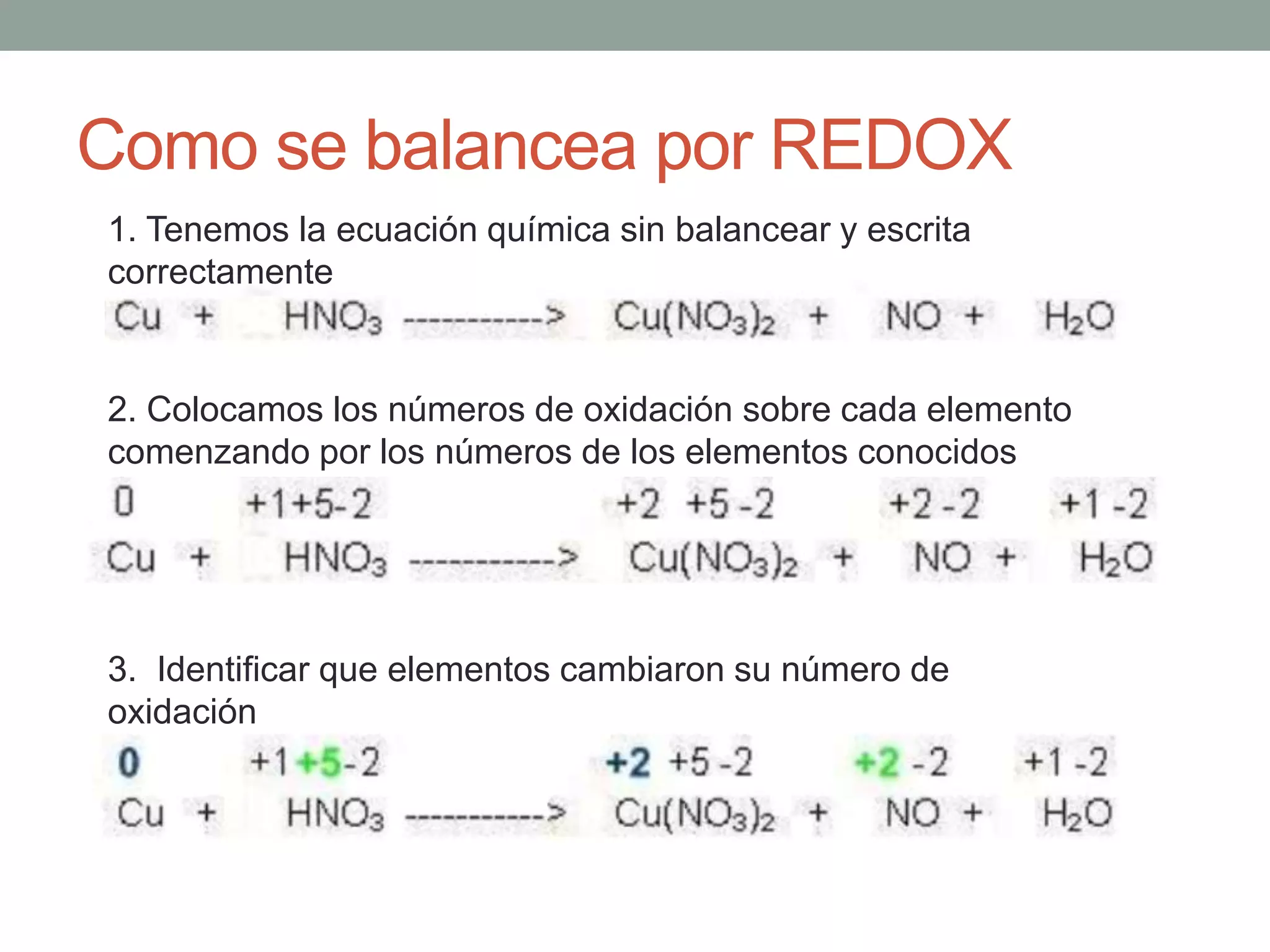
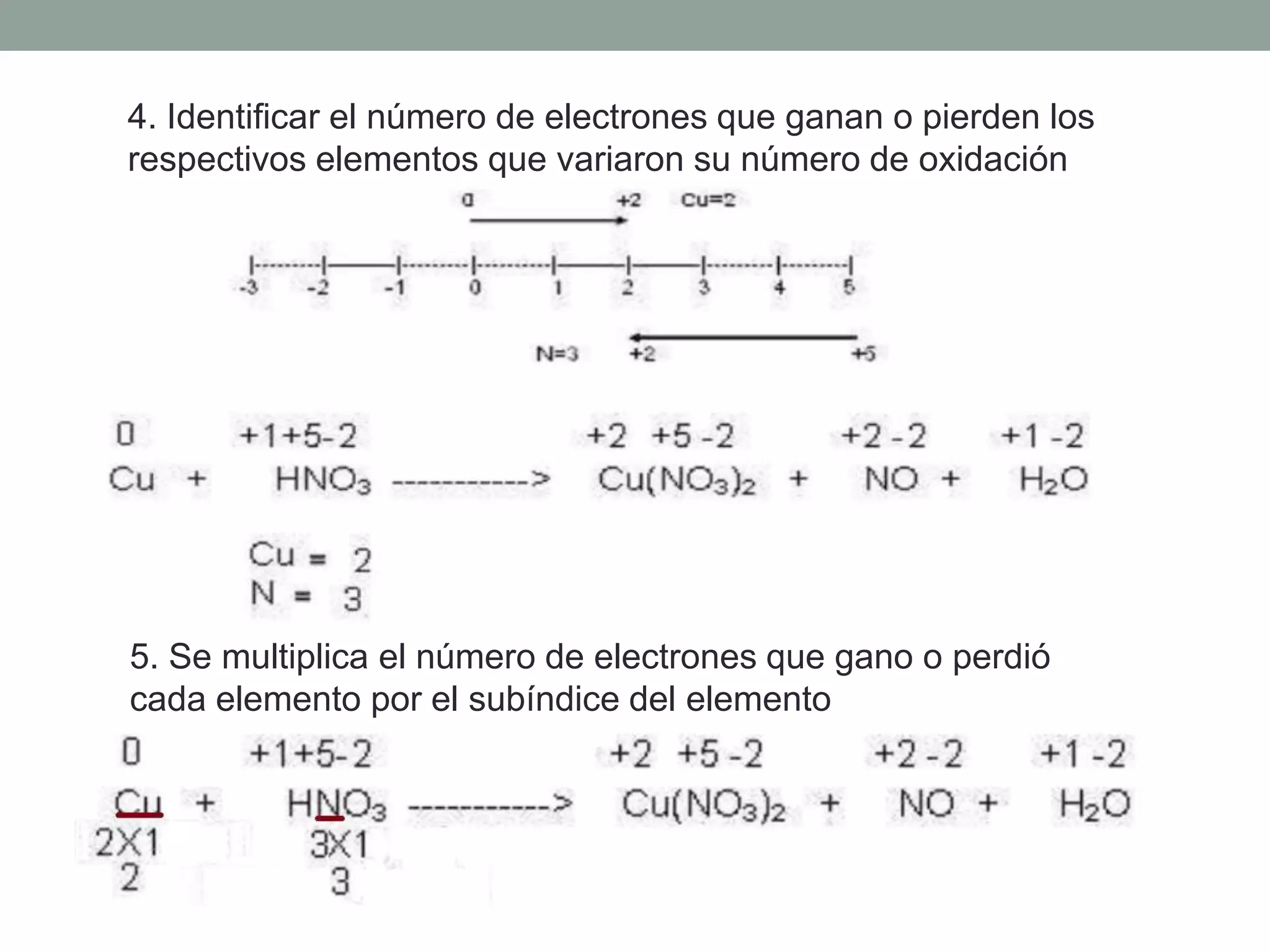
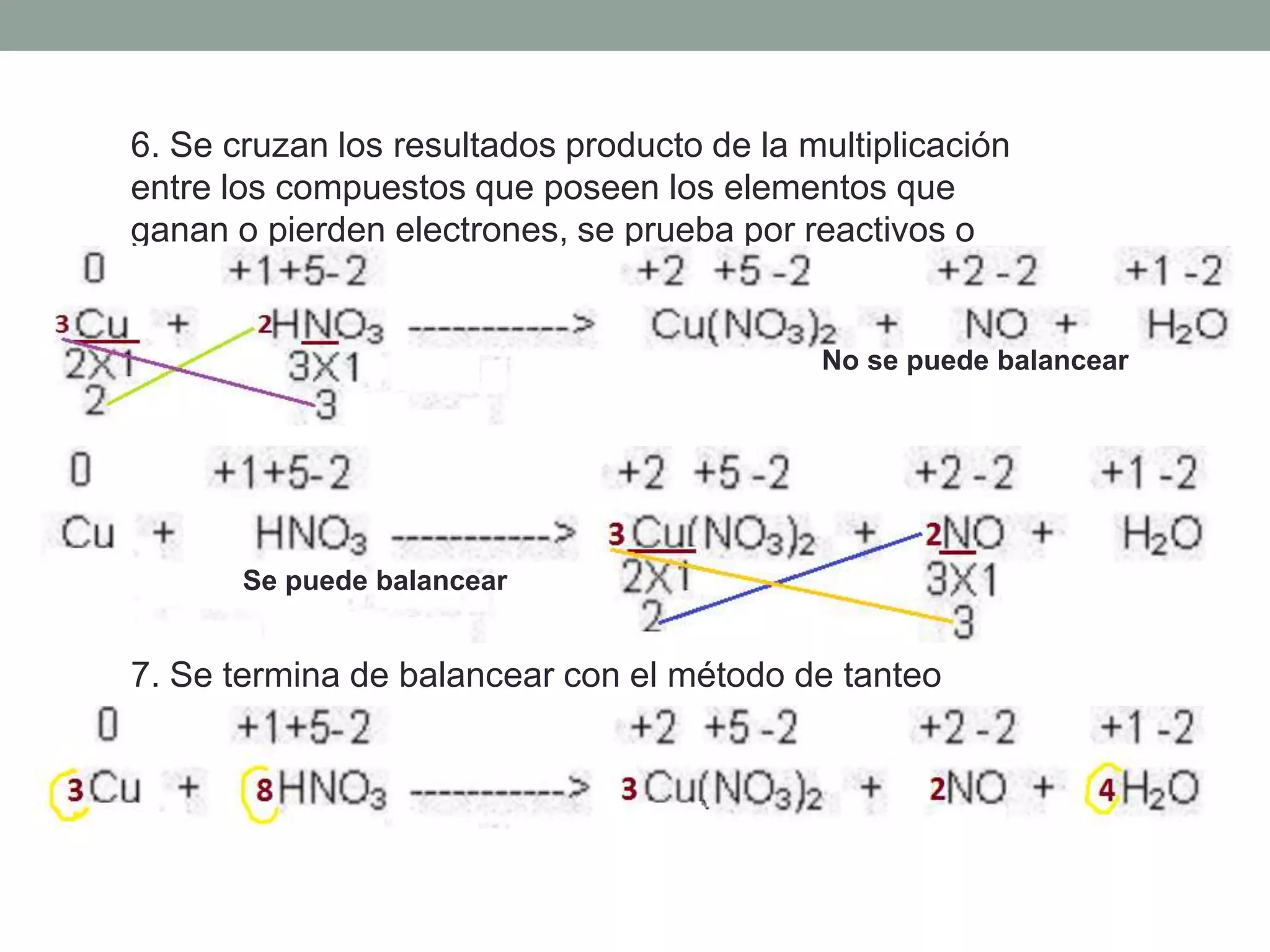
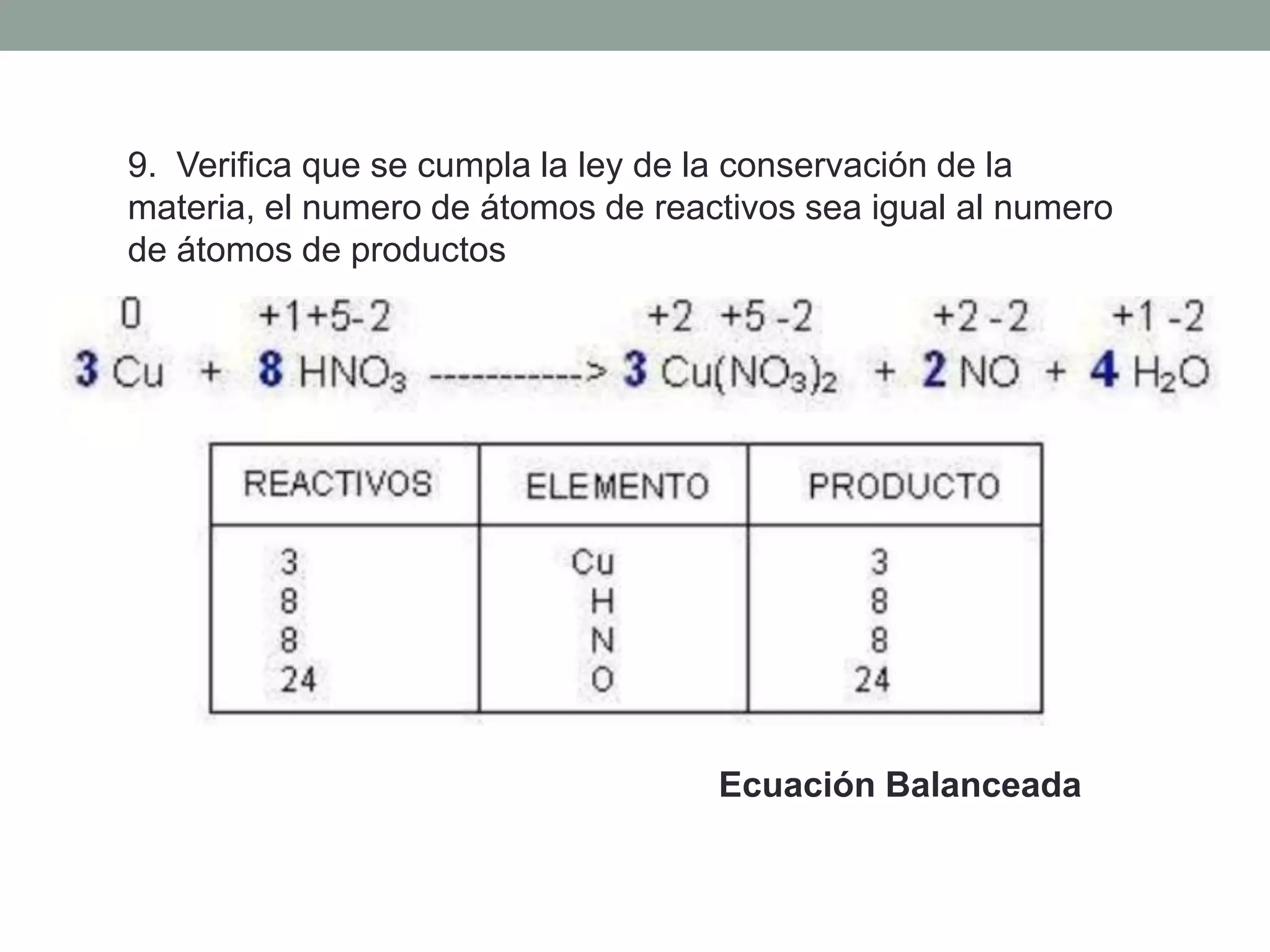
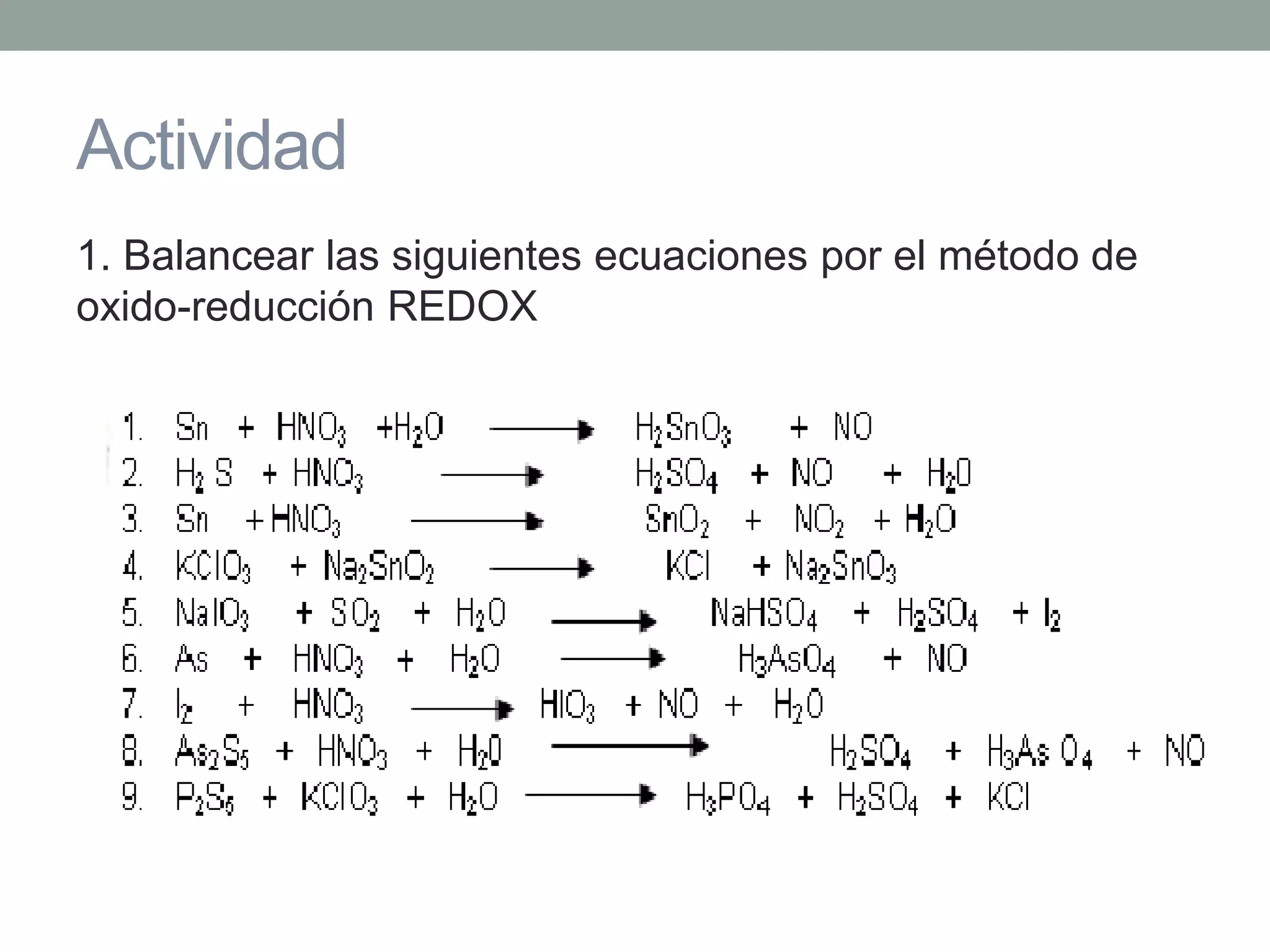

Este documento describe el método redox para balancear ecuaciones químicas. Explica que la oxidación y reducción implican la transferencia de electrones entre especies químicas, con un agente reductor que cede electrones y un agente oxidante que los acepta. Luego detalla los 7 pasos para balancear una ecuación química por este método, que incluyen identificar los cambios en los números de oxidación de los elementos y equilibrar los electrones ganados y perdidos. Finalmente, pide al lector que aplique este método para balance






