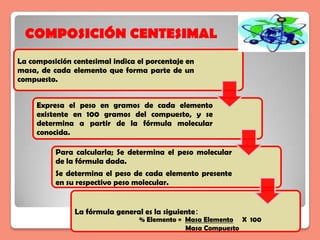
El documento presenta un contenido didáctico sobre composición centesimal, fórmula empírica y fórmula molecular en la enseñanza de la química para educación media. Proporciona metodología para calcular la composición de compuestos químicos y ejemplos prácticos, enfatizando la relación entre los elementos y sus porcentajes en masa. Además, incluye recursos didácticos sugeridos y ejercicios aplicados para facilitar el aprendizaje.