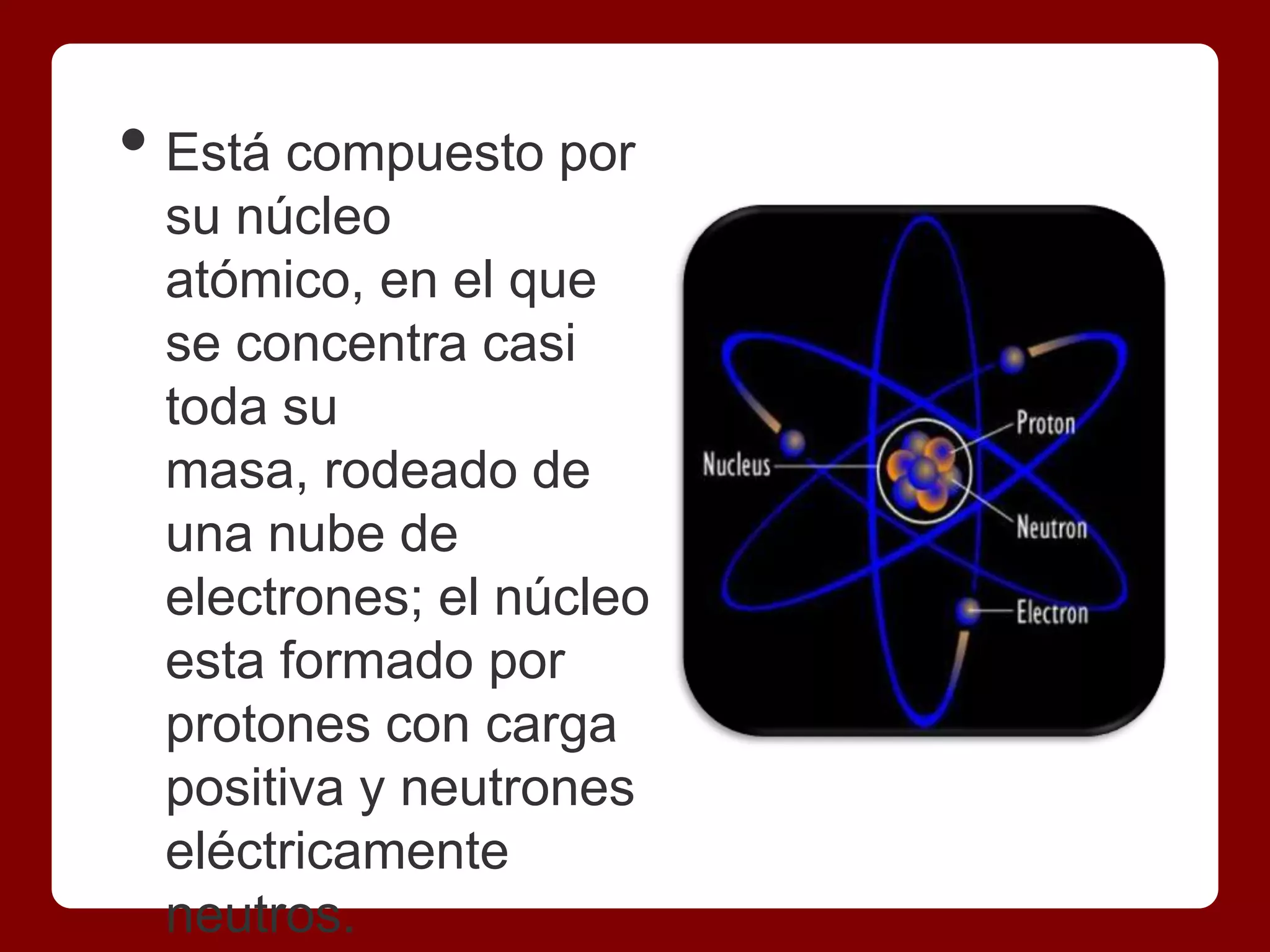
El documento aborda la estructura y propiedades de átomos y moléculas, describiendo al átomo como la unidad básica de un elemento químico compuesto por un núcleo de protones y neutrones, rodeado de electrones. Se explica el concepto de mol y el número de Avogadro, así como su relevancia en la relación entre masa y cantidad de sustancia. Además, se presentan ejemplos que ilustran cálculos relacionados con la masa de átomos y moléculas.