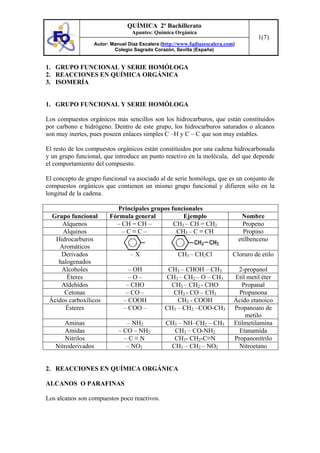
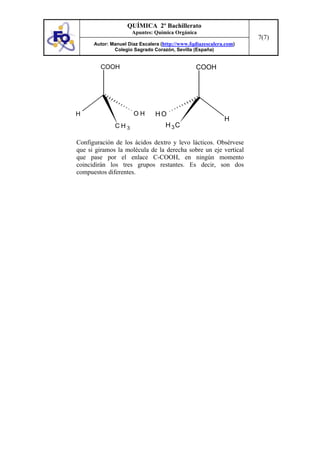
Este documento presenta conceptos clave de química orgánica como grupos funcionales, series homólogas, isomería y reacciones orgánicas. Explica los principales grupos funcionales y sus fórmulas generales, así como los tipos de isomería incluyendo isomería estructural, estereoisomería geométrica y óptica. También resume varias reacciones características de hidrocarburos, alquenos, alcoholes, aldehídos y otros compuestos orgánicos.