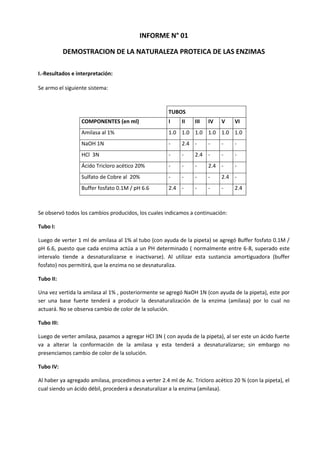
Este informe describe un experimento que demuestra la naturaleza proteica de las enzimas. Se utilizó la enzima amilasa y varios agentes como sales, ácidos, bases y temperatura para tratar de desnaturalizar la enzima. Los resultados mostraron que la amilasa solo se desnaturalizó en presencia de sales pesadas, ácidos y bases fuertes, o altas temperaturas, lo que lleva a la conclusión de que las enzimas son proteínas sensibles a factores ambientales.