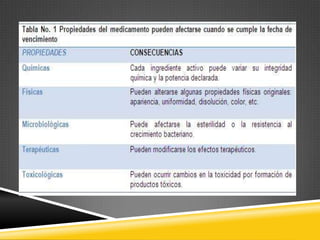
El documento trata sobre la estabilidad de los medicamentos. Explica que la estabilidad se define como la capacidad de un producto farmacéutico de mantener sus características físicas, químicas y microbiológicas dentro de límites aceptables durante su periodo de validez. Se realizan diferentes tipos de estudios de estabilidad para determinar este periodo, incluyendo estudios acelerados y a largo plazo, y se especifican los análisis requeridos para diferentes formulaciones farmacéuticas.