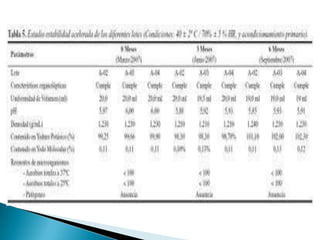
Este documento trata sobre la estabilidad de los medicamentos. Resume los principales factores que afectan la estabilidad como las condiciones ambientales como la humedad, temperatura y oxígeno, así como la incompatibilidad química. También describe los diferentes tipos de estudios de estabilidad como los acelerados y de largo plazo para determinar la fecha de vencimiento.