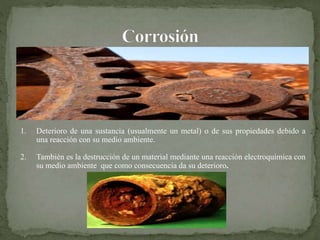
El documento describe los diferentes tipos de corrosión que pueden afectar a los metales, incluyendo la corrosión uniforme, galvánica, por picaduras, grietas e intergranular. También explica métodos para prevenir la corrosión como la selección de materiales adecuados, el uso de recubrimientos, un diseño apropiado y la alteración del entorno. La corrosión es un problema importante que reduce la vida útil de los materiales y genera altos costos económicos.