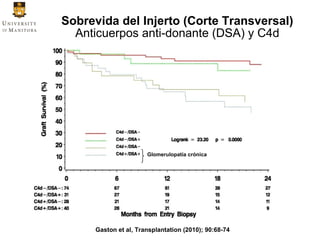
Este documento resume información sobre inmunosupresión y anticuerpos anti-donante en trasplantes renales. Presenta datos sobre incidencia de rechazo y sobrevida del injerto con el tiempo, factores de riesgo para el desarrollo de anticuerpos contra el donante, y diferentes fenotipos clínicos asociados con la presencia de estos anticuerpos. También discute temas como la importancia de la adherencia a la medicación inmunosupresora y el matching de epítopos HLA entre donante y receptor para reducir el riesgo de










![Gaston et al, Am J Transplant (2013) [Supplement meeting ATC]](https://image.slidesharecdn.com/rush-inmunosupresionyanticuerposanti-donante-140626120424-phpapp02/85/Presentacion-David-12-320.jpg)


























![Quimioquinas Urinarias y TCMR
mRNA de CXCL-10 (IP-10) en células
urinarias: En combinación con mRNA
ribosómico 18S y mRNA para CD3ε discriminó
entre TCMR y no-TCMR: AUC 0.85 [CI 0.78-
0.91]. Suthanthiran et al NEJM (2013) 369: 20.
CXCL-9 (MIG) urinario: PPV 67%; NPV 92%
para el diagnóstico de TCMR. Los niveles
bajos de CXCL-9 a los 6 meses estaban
correlacionados con la estabilidad del injerto
entre los meses 6 y 24 Hricik et al AJT (2013)
13: 2634 (Fig.).
CCL-2 (MCP-1) urinario: A los 6 meses el
cociente CCL2: Cr estaba
correlacionadoindependientemente con IF+ i at
los 24 meses [OR 2.78, 95% CI 1.38-6.12,
AUC 0.695, p=0.003]. Ho et al Transplantation
(2013) [In Press].
El diagnóstico no-invasivo de la inflamación del injerto renal es
factible, lo cual podría facilitar los protocolos de minimización.](https://image.slidesharecdn.com/rush-inmunosupresionyanticuerposanti-donante-140626120424-phpapp02/85/Presentacion-David-39-320.jpg)


