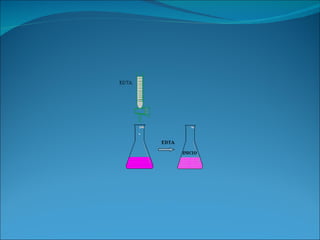
Este documento describe un proyecto para determinar la dureza del agua potable en el Concejo de Salas a través de análisis de laboratorio. Los estudiantes aprendieron sobre la dureza del agua, incluidas sus definiciones, tipos y consecuencias. Llevaron a cabo un método volumétrico utilizando EDTA para medir los iones de calcio y magnesio en muestras de agua de varias localidades, y calcularon los resultados como dureza total en mg/L de carbonato de calcio. La mayoría