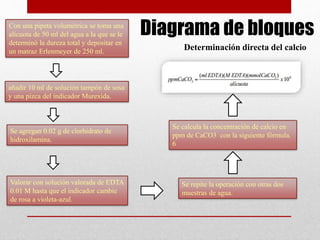
El documento describe un experimento para determinar la dureza total y la dureza del calcio en muestras de agua mediante titulación con EDTA. La dureza total se determina titulando la muestra con EDTA y un indicador, y la dureza del calcio se determina titulando una alícuota de la muestra con EDTA y un indicador diferente. Los resultados para tres muestras muestran un promedio de dureza total de 29.2606 mg/L expresada como CaCO3.