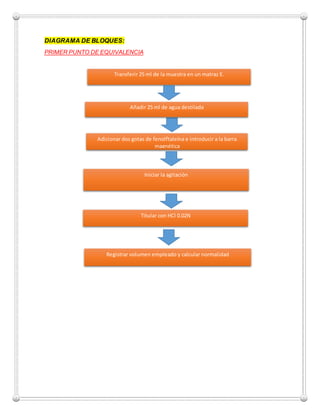
El documento detalla un experimento realizado en la universidad veracruzana para determinar la alcalinidad de muestras de agua utilizando técnicas de titulación con HCl y H2SO4. Se presentan resultados específicos de la alcalinidad en partes por millón (ppm) para una muestra de agua problema y otra de agua de caldera. Los estudiantes adquirieron habilidades en métodos de análisis químico y los resultados reflejan la importancia de medir impurezas en el agua.