Este documento describe una práctica de laboratorio sobre yodometría. La práctica prepara y evalúa soluciones estándar de tiosulfato de sodio y yodo, que son utilizados en métodos de oxidación-reducción. También analiza la toxicidad de sustancias como el ácido clorhídrico, el carbonato de sodio y el permanganato de potasio.





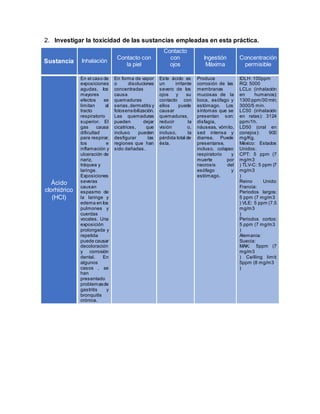

![Los síntomas
pueden
incluir tos y
dificultad
para respirar
tracto
gastrointestinal.
Publicado bajo
Dosis letal:
LDL [Mouse] -
Ruta: Vía oral;
Dosis: 1862 mg /
kg
LDL [Conejo] -
Ruta: Vía oral,
dosis: 916 mg / kg
solución
indicadora
de almidón
----------------
----------------------
Lavar con agua
abundante
manteniendo
los párpados
abiertos.
---------------------
Baja toxicidad.
No son de
esperar
características
peligrosas.
Observar las
precauciones
habituales en el
manejo de
productos
químicos
Yodo
Corrosivo.
Los vapores
irritan
severamente
y puede
quemar las
membranas
mucosas y
vías
respiratorias.
Llanto
excesivo,
rinitis,
opresión en
el pecho,
dolor de
garganta,
dolor de
cabeza y
edema
pulmonar
retardado
pueden
presentarse.
La inhalación
de vapores
concentrados
puede ser
fatal.
Corrosivo. El
contacto con el
líquido puede
causar
quemaduras con
ampollas, irritación
y dolor. Los
vapores pueden
ser sumamente
irritantes para la
piel.
Corrosivo! Los
vapores son
sumamente
irritantes y
pueden causar
daño a los
ojos. El
contacto puede
causar graves
quemaduras y
lesiones
oculares
permanentes.
Corrosivo. Puede
causar graves
quemaduras de
la boca, garganta
y estómago.
Causa dolor
abdominal,
diarrea, fiebre,
vómitos, estupor
y shock. La
probable dosis
letal es de 2 a 4 g
de yodo libre.
Publicado bajo
Dosis letal:
LDL [humanos] -
Ruta: Vía oral,
dosis: 28 mg / kg
LCL [Rata] - Ruta:
La inhalación;
Dosis: 137
ppm/1h
Na2S2O3 .
5 H2O
Nocivo Aire
fresco
Provoca irritación
cutánea.
Provoca
irritación ocular
grave.
Nocivo](https://image.slidesharecdn.com/yodometra9-141008000228-conversion-gate01/85/Yodometria-9-8-320.jpg)







