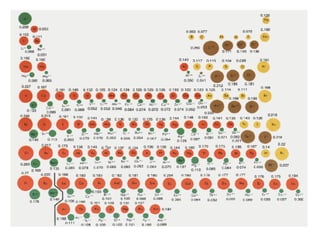
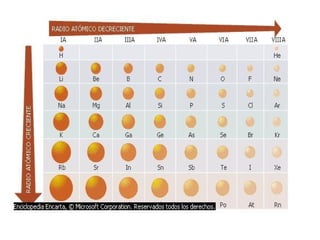
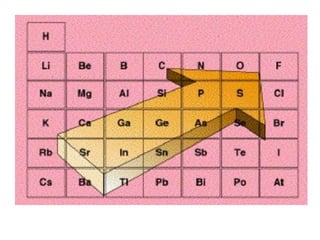
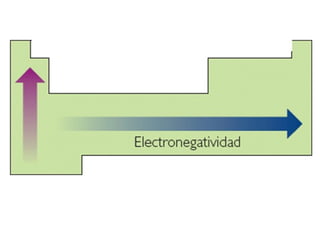
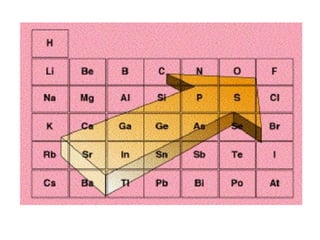
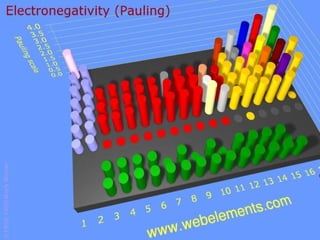
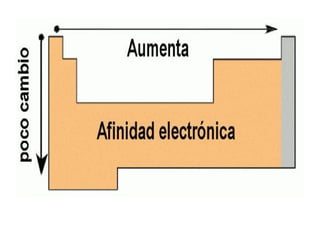
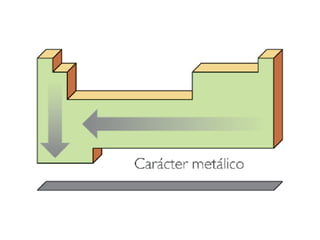
Este documento resume las características químicas de los elementos que varían según su posición en la tabla periódica, incluyendo el radio atómico, el radio iónico, la energía de ionización, la electronegatividad, la afinidad electrónica y el carácter metálico. Explica que los elementos más grandes y con mayor energía de ionización, electronegatividad y afinidad electrónica se encuentran más arriba y a la derecha en la tabla, mientras que los elementos con mayor carácter metálico se ub