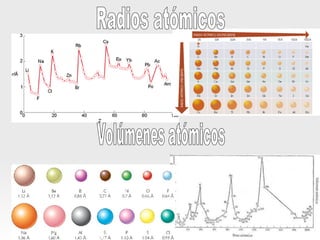
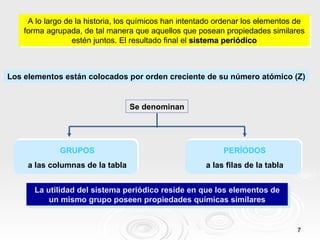
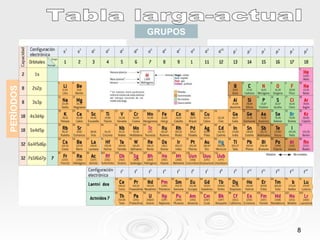
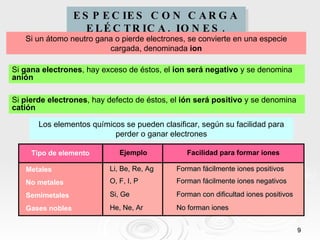
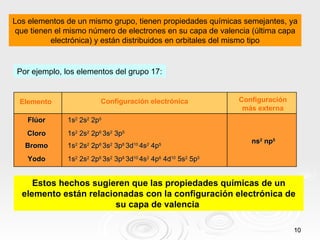
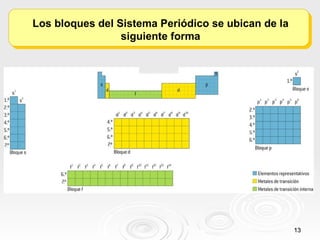
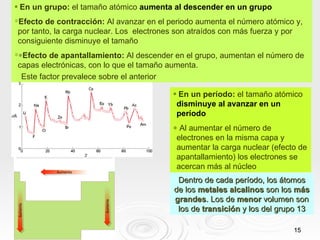
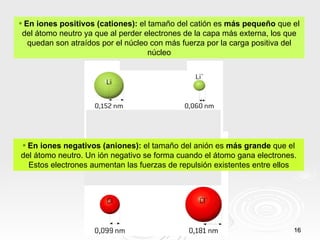
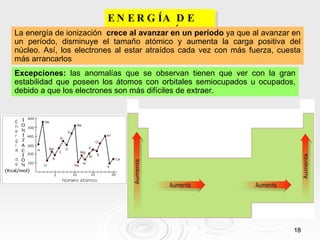
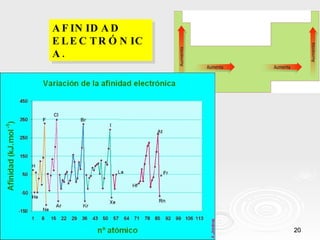
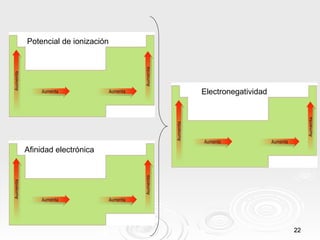
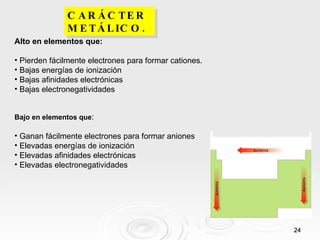
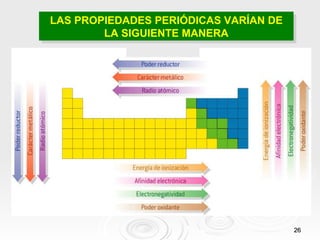
El documento resume las propiedades periódicas de los elementos químicos, incluyendo cómo varían el tamaño atómico, la energía de ionización, la afinidad electrónica, la electronegatividad y la reactividad a través de la tabla periódica. Explica que estas propiedades tienden a aumentar al descender en un grupo y disminuir al avanzar en un período, con algunas excepciones. También clasifica los elementos como metales, no metales y semimetales según su facilidad para ganar o perder