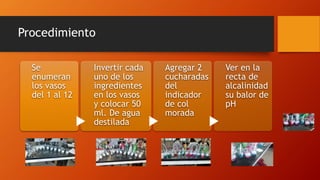
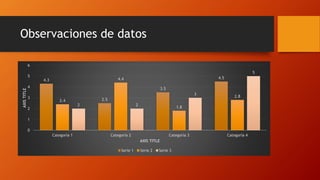
El documento habla sobre varios métodos para evitar la corrosión, incluyendo recubrir metales con zinc, plásticos o pinturas especiales, y usar ánodos de zinc. También describe experimentos para medir el pH de sustancias y observar cómo el vinagre oxida más una fibra de metal que el agua salada o normal.