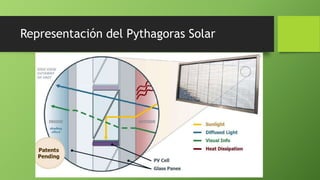
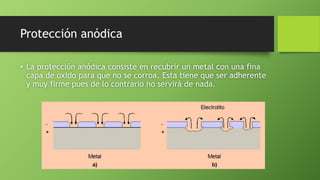
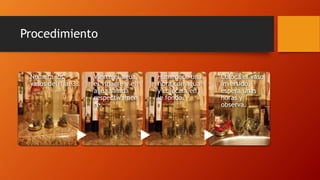
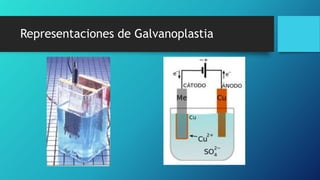
Este documento presenta varios temas relacionados con la corrosión y formas de prevenirla. Incluye información sobre cómo científicos han desarrollado recubrimientos para proteger componentes metálicos y extender la vida de turbinas. También describe un experimento que muestra cómo el vinagre causa más corrosión en una fibra metálica que el agua o agua salada. Por último, explica métodos como la galvanoplastia y protección catódica para prevenir la corrosión.