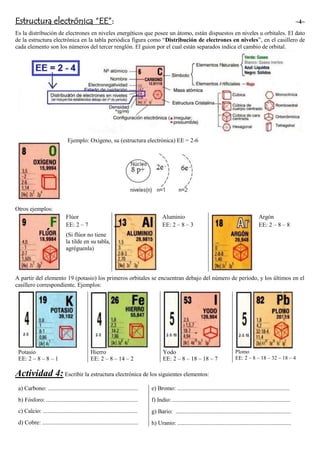
El documento explica la estructura electrónica, que es la distribución de electrones en niveles y orbitales energéticos de un átomo. Se proporcionan ejemplos de la estructura electrónica de varios elementos como oxígeno, flúor, aluminio y argón. Además, se indica que a partir del potasio, los primeros electrones se encuentran debajo del número de período y los últimos en el casillero correspondiente, dando ejemplos de potasio, hierro, yodo y plomo. Finalmente, se pide esc