1) El documento presenta equivalencias entre unidades de presión como atmósferas, mmHg, Pa y bares. También define la constante de Avogadro.
2) Se describen las características de las partículas atómicas como protón, neutrón y electrón, indicando su masa y carga.
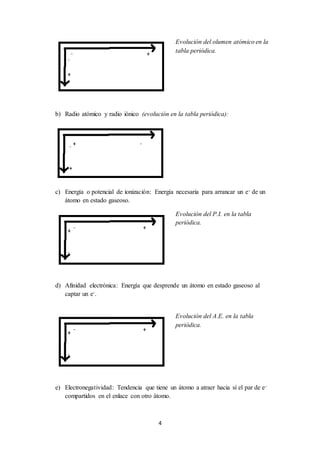
3) Se explican conceptos fundamentales de química como los modelos atómicos, la tabla periódica, las propiedades periódicas, los diferentes tipos de enlace, reacciones químicas y cálculos estequ
![Química
1
Equivalencias
1 atm ≈ 760 mmHg = 101325 Pa = 1,01325 bar = 760 Torr
1 푚표푙 = 푃. 푚. (푝푒푠표 푚표푙푒푐. 표 푎푡. ) = 6.023 · 1023푚표푙é푐. 표 á푡.
= 22.4푙 (푔푎푠푒푠 푖푑푒푎푙푒푠 푒푛 푐표푛푑푖푐푖표푛푒푠 푛표푟푚푎푙푒푠)
CARACTERÍSTICAS DE LAS PARTÍCULAS ATÓMICAS
Protón: mp = 1, 67·10-27 kg = 1,007 u ; qp = + 1, 60·10– 19 C
Neutrón: mn = 1, 68·10-27 kg = 1,009 u ; qn = 0
Electrón: me = 9,11·10 -31 kg = 0,0005 u ; qe = – 1, 60·10– 19 C
Formulario
T1. Principios de química
푛 = 푚푎푠푎 푡표푡푎푙
푃 .푚.
→ [ 푔
푔/푚표푙
= 푚표푙]
- Cálculo de composición centesimal
Nos dan un compuesto, se debe hallar la proporción de cada elemento que compone el
compuesto en relación a dicha compuesto. Como fórmula general para hacernos una
idea se tendría:
퐶. 푐푒푛푡. 푑푒 푒푙푡표. =
푃. 푎. (푝푒푠표 푎푡ó푚푖푐표)푑푒 푒푙푡표.· 푛º 푑푒 á푡. 푑푒 푑푖푐ℎ표 푒푙푡표.
푃 . 푚. 푑푒 푐표푚푝푢푒푠푡표
· 100 = ____%
- Cálculo de fórmula a partir de C. cent.
1º. Calcular la masa de cada elemento que forma la molécula, o también su C. cent..](https://image.slidesharecdn.com/qumica-141120132533-conversion-gate02/85/Quimica-1-320.jpg)