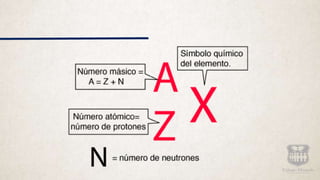
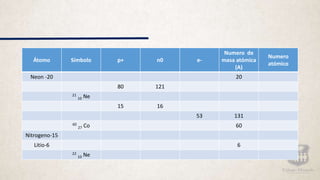
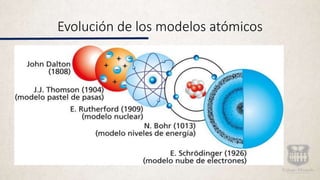
Este documento resume la evolución de los modelos atómicos a través de la historia, comenzando con la idea de Demócrito de que la materia está compuesta de átomos indivisibles. Explica los modelos atómicos de Dalton, Thomson, Rutherford y Bohr, y cómo cada uno contribuyó a mejorar la comprensión de la estructura atómica hasta llegar al modelo cuántico actual.