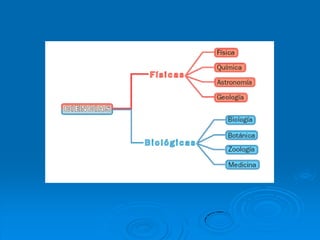
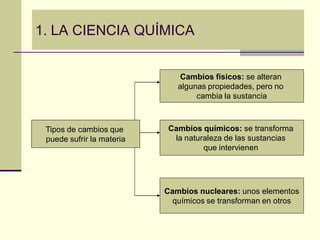
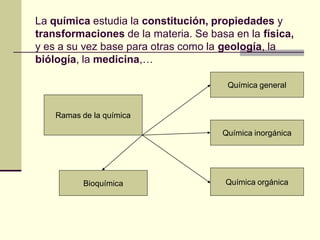
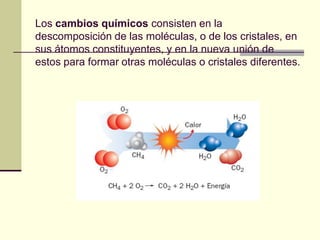
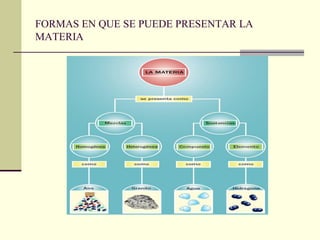
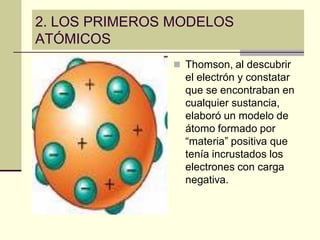
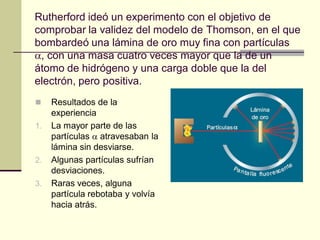
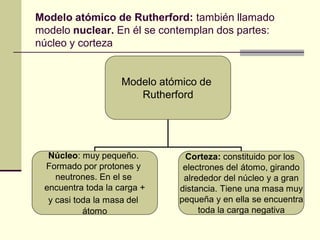
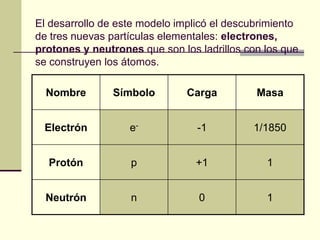
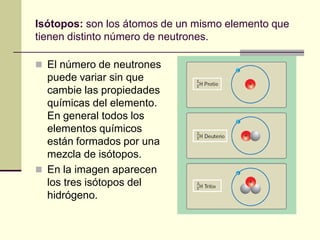
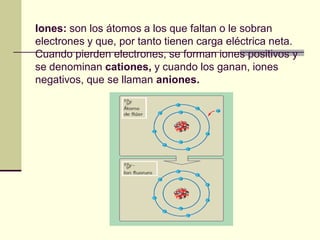
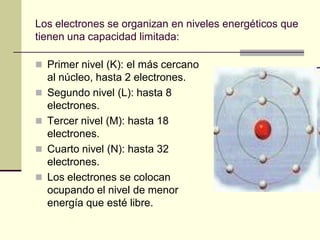
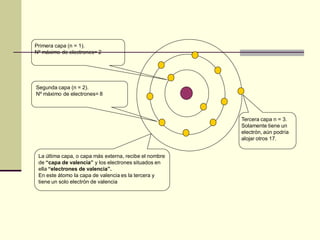
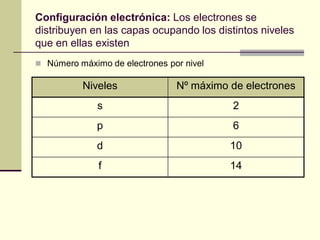
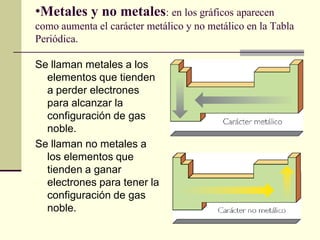
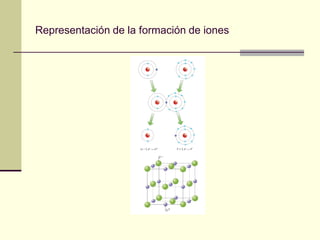
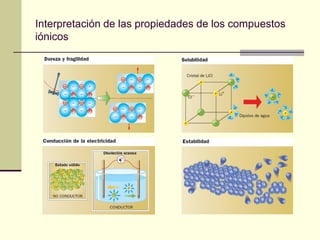
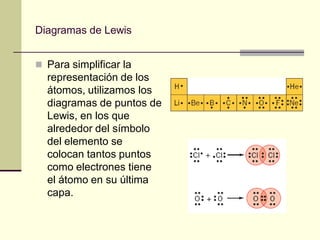
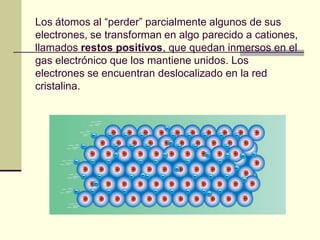
Este documento trata sobre los átomos y los enlaces químicos. Explica los primeros modelos atómicos de Thomson y Rutherford, el descubrimiento del núcleo atómico, los protones, neutrones y electrones. También describe el modelo atómico de capas de Bohr y el modelo cuántico actual. Finalmente, analiza los tipos de enlaces químicos como los iónicos, covalentes y metálicos.