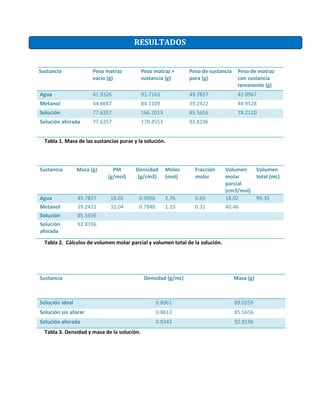
Este documento presenta los resultados de un experimento para determinar los volúmenes molares parciales y totales de una solución de agua y metanol. Se midieron las masas de las sustancias puras y la solución, y se calcularon las fracciones molares, volúmenes molares parciales y total de la solución. Los resultados muestran que los volúmenes molares parciales coinciden con los valores de propiedad molar, demostrando que dependen de la composición de la solución pero no de la cantidad total.