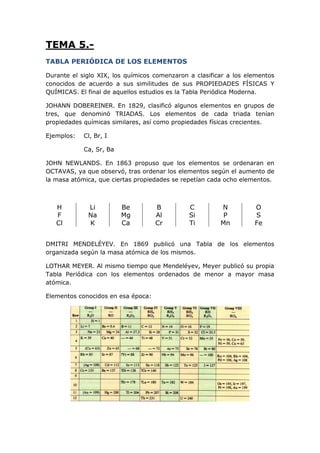
El documento describe la historia y desarrollo de la tabla periódica de los elementos, incluyendo las contribuciones de Dobereiner, Newlands, Mendeléyev y Meyer. Explica la distribución y clasificación de los elementos en la tabla periódica de acuerdo a sus propiedades periódicas y de valencia. También define los diferentes grupos de elementos como metales alcalinos, metales alcalinotérreos, metales de transición, halógenos, gases nobles y sus características.