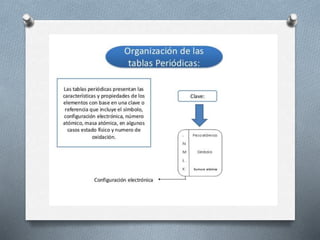
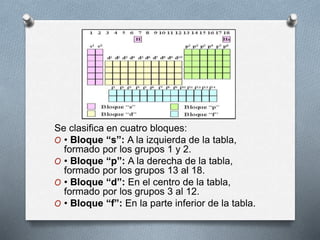
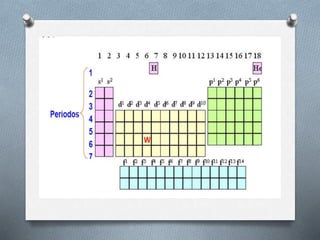
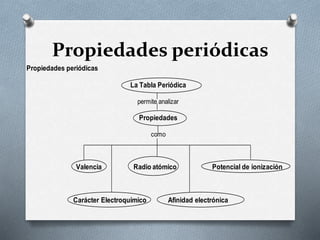
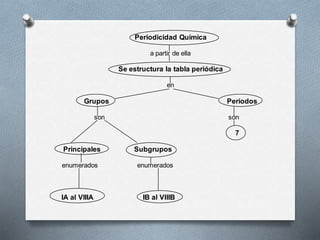
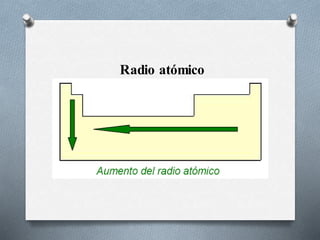
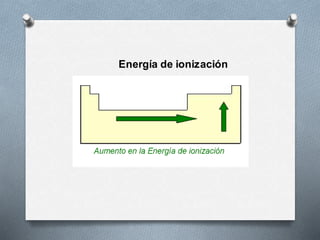
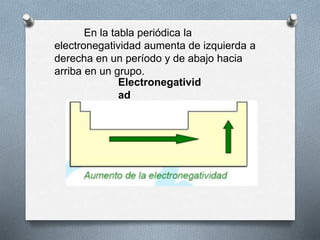
El documento describe la historia y desarrollo de la tabla periódica de los elementos. Explica que John Newlands observó una periodicidad en las propiedades de los elementos en 1864, pero que fue Mendeleev quien propuso una versión más completa de la tabla periódica en 1869 que permitió predecir propiedades de elementos aún no descubiertos. Más tarde, en 1913, Moseley ordenó los elementos según su número atómico y estableció la ley periódica. La tabla periódica actual clasifica los elementos en grupos y períodos