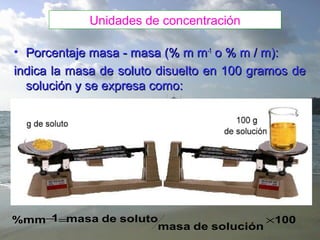
El documento describe las propiedades y características de las soluciones. Explica que una solución contiene un soluto disuelto en un solvente. Luego discute factores que afectan la solubilidad como la temperatura, presión, estado de agregación y afinidad química entre soluto y solvente. También cubre diferentes tipos de soluciones como verdaderas, coloidales y suspensiones, así como unidades para medir concentración como molaridad, molalidad y normalidad.