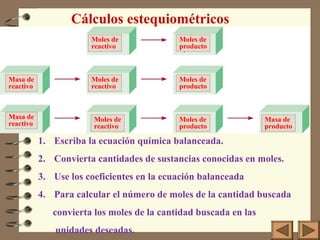
Este documento trata sobre la estequiometría y conceptos relacionados como masa atómica, mol y peso molecular. Explica que la estequiometría es el procedimiento químico-matemático para determinar las cantidades de reactivos y productos en una reacción química. También define conceptos como masa, peso, masa atómica, mol y unidades de masa atómica usando al carbono-12 como patrón. Finalmente, introduce las leyes de conservación de masa, proporciones definidas y proporciones m