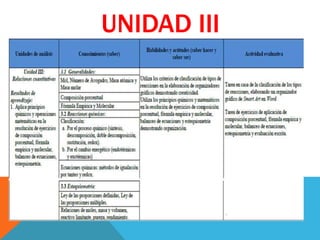
Unidad iii
- 1. UNIDAD III
- 2. MASA ATOMICA masa atómica(m. a.), es la suma de sus protones y neutrones y varía en los distintos elementos de la tabla periódica MASA MOLECULAR Se calcula sumando las masas atómicas de los elementos que componen la molécula. Así, en el caso del agua: H2O, su masa molecular es: H=2 x 1,00007 + O= 15.9999 = 16 u (Uma) MOL Un mol es la cantidad de materia que contiene 6,02 x 1023 partículas elementales (ya sea átomos, moléculas, iones, partículas subatómicas, etcétera) en 12 gramos de Carbono. También se llama Número de Avogadro. Por ejemplo, una mol de etanol es igual a 6.023 × 10 23 moléculas de etanol
- 4. Los átomos son demasiado pequeños para permitir medidas significativas de sustancias químicas. Para trabajar con cantidades significativas de sustancias, los científicos las agrupan en unidades llamadas moles. Un mol es definido como el número de átomos de carbono en 12 gramos de un isótopo de carbón-12, el cual es 602,2 sextillones (6,022 por 10 a la potencia 23) de átomos. Este número es llamado número de Avogadro o constante de Avogadro. Es usado como el número de átomos para cualquier sustancia y la masa de 1 mol de una sustancia es su masa molar. NUMERO AVOGADRO
- 5. PASOS PARA CALCULAR MOLES: PASOS PARA CALCULAR MOLES: 1. Identifica el compuesto o elemento que debas convertir a moles. 2. Encuentra el elemento en la tabla periódica. 3. Anota el peso atómico del elemento. Por lo general, éste es el número que se encuentra en la parte inferior, por debajo del símbolo del elemento. Por ejemplo, el peso atómico del helio es 4,0026. Si debes identificar la masa molar de un compuesto, debes sumar todos los pesos atómicos de cada elemento del compuesto. 4. Multiplica el número de gramos del elemento/compuesto por la fracción 1/masa molar. Esto es 1 mol dividido por los pesos atómicos que acabas de obtener. Puedes expresar esto como una fracción del número de gramos por 1 mol dividido por la masa molar, o “compuesto g x 1/masa molar (g/mol) = moles”. 5. Divide ese número por la masa molar. El resultado es el número de moles de tu elemento o compuesto. Por ejemplo, imagina que tienes 2 g de agua, o H20, y quieres convertirlo a moles. La masa molar del agua es 18 g/mol. Multiplica 2 veces 1 para obtener 2. Divide 2 por 18, y tienes 0,1111 moles de H20.
- 6. EJEMPLOS: CÁLCULO DE MOLES
- 8. Es la unión de dos o más sustancias para formar otras con propiedades diferentes. En una reacción química se pueden especificar dos componentes: Los reactivos o reactantes, que forman el primer miembro de la reacción; y los productos, que constituyen el segundo miembro de la reacción y son sustancias que se obtienen o se forman. En algunas reacciones químicas se indica el estado de los componentes de la reacción: sólido, líquido y gaseoso. También se puede indicar la reacción con dos flechas, cuando se trata de una doble reacción. REACCIONES QUÍMICAS
- 9. TIPOS DE REACCIONES QUÍMICAS
- 10. BALANCEO DE ECUACIONES QUÍMICAS Una reacción química es la manifestación de un cambio en la materia y la representación de un fenómeno químico. A su expresión escrita se le da el nombre de ecuación química, en la cual se expresa los reactivos a la izquierda y los productos de la reacción a la derecha, ambos separados por una flecha. Más exactamente, a la izquierda del símbolo indicamos el contenido inicial del sistema en reacción (reactivos), y a la derecha el contenido del sistema final (productos). Cada sustancia se representa por su fórmula química, y posteriormente debemos ajustar toda la ecuación. Para equilibrar o balancear ecuaciones químicas, existen diversos métodos. En todos, el objetivo que se persigue es que la ecuación química cumpla con la ley de la conservación de la materia.
- 11. MÉTODO TANTEO El método de tanteo, se utiliza principalmente para buscar el equilibrio de una reacción química de una manera rápida, en ecuaciones sencillas y completas, de tal forma que dicho procedimiento no retrase el proceso principal por el cual se requiera dicho balanceo Pasos a seguir: - Tomemos en cuenta que una reacción química al estar en equilibrio, debe mantener la misma cantidad de moléculas o átomos, tanto del lado de los reactivos como del lado de los productos. - Si existe mayor cantidad de átomos de x elemento de un lado, se equilibra completando el número de átomos que tenga en el otro lado de la reacción. - Es recomendable comenzar en el siguiente orden: metales, no metales, hidrógeno y por último oxígeno.
- 12. MÉTODO ALGEBRAICO Este método es un proceso matemático que consistente en asignar literales a cada una de las especies , crear ecuaciones en función de los átomos y al resolver las ecuaciones, determinar el valor de los coeficientes. Ecuación a balancear: FeS + O2 Fe2O3 + SO2 Los pasos a seguir son los siguientes: 1. Escribir una letra, empezando por A, sobre las especies de la ecuación: 2. Escribir los elementos y para cada uno de ellos establecer cuántos hay en reactivos y en productos, con respecto a la variable. Por ejemplo hay un Fe en reactivos y dos en productos, pero en función de las literales donde se localizan las especies (A y C) se establece la ecuación A = 2C . El símbolo produce ( ) equivale al signo igual a (=). Fe A = 2C S A = D O 2B = 3C + 2D
- 13. 3. Utilizando esas ecuaciones, dar un valor a cualquier letra que nos permita resolver una ecuación (obtener el valor de una literal o variable) y obtener después el valor de las demás variables. Es decir se asigna un valor al azar (generalmente se le asigna el 2) a alguna variable en una ecuación, en este caso C = 2 , de tal forma que al sustituir el valor en la primera ecuación se encontrará el valor de A. Sustituyendo el valor de A en la segunda ecuación se encuentra el valor de D y finalmente en la tercera ecuación se sustituyen los valores de C y D para encontrar el valor de B. Fe A = 2C Sí C =2 A= D 2B = 3C + 2D S A = D A= 2C D = 4 2B = (3)(2) + (2)(4) O 2B = 3C + 2D A= 2(2) 2B = 14 A = 4 B = 14/2 B = 7 4. Asignar a cada una de las especies el valor encontrado para cada una de las variables: A B C D 4 FeS + 7 O2 2Fe2O3 + 4SO2
- 14. MÉTODO REDOX La oxidación se refiere a: La ganancia de oxígeno por parte de una molécula La pérdida de hidrógeno en una molécula La pérdida de electrones que sufre un átomo o grupo de átomos Aumentando en consecuencia su número de oxidación La reducción se refiere a: La pérdida de oxígeno por parte de una molécula La ganancia de hidrógeno en una molécula La ganancia de electrones que sufre un átomo o grupo de átomos Disminución o reducción en su número de oxidación Los procesos de oxidación y reducción suceden simultáneamente y nunca de manera aislada, por lo que se denominan reacciones redox.
- 15. Paso 1. Asignar el número de oxidación de todos los elementos presentes en la reacción y reconocer los elementos que se oxidan y reducen. Nota: Todo elemento libre tiene número de oxidación cero. Paso 2. Escribir las semirreacciones de oxidación y reducción con los electrones de intercambio. Paso 3. Balancear el número de átomos en ambos lados de las semirreacciones. En este caso están balanceados: Paso 4. Igualar el número de electrones ganados y cedidos: Nota: El número de electrones ganados debe ser igual al número de electrones cedidos. Paso 5. Colocar los coeficientes encontrados en la ecuación original donde se verificó el cambio del número de oxidación: Paso 6. Completar el balanceo ajustando el número de átomos en ambos lados de la reacción por tanteo
- 16. Observación 1: Cuando los coeficientes calculados, no igualan la ecuación es recomendable duplicarlos. Observación 2: Cuando hay dos o más oxidaciones o reducciones, se pueden sumar las oxidaciones y reducciones para igualar la ecuación. Observación 3: Cuando en una misma molécula, un átomo se oxida y otro se reduce para obtener el coeficiente de oxidación y reducción se hace una resta Observación 4: En los peróxidos la valencia del oxígeno es - 1 OBSERVACIONES:
- 17. La estequiometria es el área de la química que estudia la relación entre las moléculas de reactantes y productos dentro de una reacción química. Como sabemos, para que se forme un compuesto debe haber una separación, combinación o reordenamiento de los elementos, lo que se puede ilustrar por medio de una reacción, la cual representa el proceso que ocurrió para que un determinado reactante llegara a ser un producto. Reactantes →Productos ESTEQUIOMETRÍA
- 18. LEY DE LAS PROPORCIONES DEFINIDAS (Louis Joseph Proust 1754-1826). En la formación de un compuesto, la proporción de elemento que se combina con una masa definida de otro elemento, será siempre la misma, es decir, cada compuesto químico, contiene siempre los mismos elementos unidos en idénticas proporciones. por ejemplo, del cloruro sódico indica que para formar 5 g de cloruro sódico, se necesitan 3 g de cloro y 2 g de sodio, por lo que la proporción entre las masas de ambos elementos es: Si hacemos reaccionar ahora 10 g de cloro, como se calcular cuántos g de sodio se necesita y cuál es la proporción entre las masas:
- 19. LEY DE LAS PROPORCIONES MÚLTIPLES (Jonh Dalton). "Las cantidades variables de un mismo elemento que se combinan con una cantidad fija de otro para formar dos o más compuestos distintos, se encuentran en una relación numérica sencilla". Un ejemplo de aplicación de la ley de Dalton es el siguiente: 16 g de oxígeno pueden combinarse con 14 g de nitrógeno para producir monóxido de nitrógeno, o con 7 g de nitrógeno para formar dióxido de nitrógeno. Se obtiene una relación de números enteros sencilla entre las cantidades variables de nitrógeno que se combinan con una misma cantidad de oxígeno. 7:14 = 1:2
- 20. REACTIVO LIMITANTE Y REACTIVO EN EXCESO El reactivo limitante es aquel que limita la reacción. Es decir: una vez que este reactivo se acaba, termina la reacción. El reactivo que sobra se llama reactivo excedente. Por lo tanto, la cantidad de producto que se forme depende de la cantidad de reactivo limitante. Este depende de la reacción y es distinto para cada una de ellas. Por ejemplo: Si debemos hacer sándwich de queso, y para ello disponemos de siete panes y sólo cinco láminas de queso, ¿cuántos sándwiches podré hacer? Sólo podré hacer cinco sándwiches, y por tanto las láminas de queso serán el reactivo limitante de este proceso, mientras que el pan será el reactivo excedente.
- 21. REACTIVO LIMITANTE Y REACTIVO EN EXCESO REACTIVO LIMITANTE (R.L.): • Aquel reactivo que se consume en su totalidad durante la reacción y que limita la cantidad de producto a obtener, siendo que existe otro que no se consume en su totalidad y del cual sobra un resto sin reaccionar. REACTIVO EN EXCESO (R.E.): • Aquel reactivo que NO se consume en su totalidad durante la reacción y del cual sobra un resto sin reaccionar, siendo que existe otro que limita la cantidad de producto a obtener y que no se consume en su totalidad.
- 22. REACTIVO LIMITANTE Y EN EXCESO Pasos: 1. Igualar la ecuación 2. Calcular UMA 3. Calcular moles 4. Dividir los moles obtenidos para el coeficiente molar El compuesto con menor número de moles será el reactivo limitante y el mayor será el reactivo en exceso. A partir de los moles obtenidos del reactivo limitante, se busca mediante regla de tres el valor de moles del otro reactivo. Para calcular el exceso se trabaja con los moles del compuesto en exceso menos el valor obtenido de la regla de tres Para calcular la masa del exceso se multiplica los moles por la UMA
- 23. EJEMPLO Si tengo 15 moles de hidrógeno y 10 moles de nitrógeno, ¿cuál será el reactivo limitante, cuál el reactivo en exceso, y cuántos moles de amoníaco se podrán obtener? Lo primero que debemos hacer es ajustar la reacción, es decir, colocar los coeficientes estequiométricos adecuados, para que el número de átomos en los reactivos sea igual al número de átomos en los productos, y de esta manera cumplir con la ley de conservación de la materia. Entonces la reacción ajustada (al tanteo), quedará de la siguiente manera: 3H2 + N2 = 2NH3 Esto se interpreta así: 3 moléculas o moles de hidrógeno reaccionan con una molécula o mol de nitrógeno para obtener 2 moles o moléculas de amoníaco. Entonces, si tengo 15 moles de hidrógeno, reaccionarán con 5 moles de nitrógeno, sobrando otros 5 moles de este elemento. Por lo tanto en este caso, el hidrógeno es el reactivo limitante, y el nitrógeno, el reactivo en exceso. Si con tres moles de hidrógeno se producirían dos moles de amoníaco, con 15 moles de hidrógeno obtendremos 10 moles de amoníaco.
- 24. PORCENTAJE DE RENDIMIENTO Sirve para determinar la eficiencia de una reacción específica. Se obtiene del: Rendimiento experimental (real) x 100 Rendimiento teórico Rendimiento experimental es el que se obtiene después de un proceso de reacción, que se puede ver afectado por factores como la presión, temperatura, cantidades de reactivos, la pureza, etc. Rendimiento teórico: se calcula a partir del reactivo limitante
- 25. PASOS PARA CALCULAR PORCENTAJE DE RENDIMIENTO 1. Balancear la reacción 2. Convertir a moles todas las cantidades 3. Determinar el reactivo limitante 4. Calcular el rendimiento teórico 5. Identificar el rendimiento experimental 6. Calcular el porcentaje de rendimiento
- 26. % PUREZA Algunas reacciones trabajan con sustancias puras, lo que quiere decir que hay que eliminar las impurezas sobretodo cuando se trata de sustancias minerales. Con frecuencia en los laboratorios e industrias reactivos que se emplean presentan impurezas y esto afecta la calidad del producto, el cual no se obtendrá en estado puro. Como las relaciones estequiométricas se basan en sustancias puras es necesario estar seguros de que las cantidades tomadas para los cálculos correspondan a material puro que se encuentra en los reactivos con impurezas. La cantidad sustancia pura (SP) de una sustancia impura (SI) se puede calcular de la siguiente manera: SP = (SI x %Pureza)/100