El documento explica cómo calcular el pH de ácidos y bases fuertes y débiles. Describe que los ácidos y bases fuertes se disocian completamente en iones en solución acuosa, mientras que los ácidos débiles solo se disocian parcialmente. Proporciona ejemplos de cálculos de pH para un ácido fuerte (HCl), una base fuerte (Ba(OH)2) y un ácido débil (HCN).

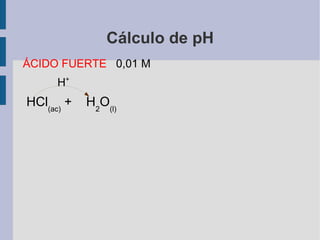

![Cálculo de pH ÁCIDO FUERTE 0,01 M H + HCl (ac) + H 2 O (l) Cl - (ac) + H 3 O + (ac) el ácido está totalmente disociado [ HCl (ac) ] o =0,01M [ H 3 O + ]=0,01M](https://image.slidesharecdn.com/t6-acido-base-calculos-de-ph-3368/85/T6-Acido-Base-Calculos-de-pH-4-320.jpg)
![Cálculo de pH ÁCIDO FUERTE 0,01 M H + HCl (ac) + H 2 O (l) -> Cl - (ac) + H 3 O + (ac) el ácido está totalmente disociado [ H 3 O + ]=0,01M pH= - log [ H 3 O + ] pH= - log 0,01 pH=2 (muy ácido)](https://image.slidesharecdn.com/t6-acido-base-calculos-de-ph-3368/85/T6-Acido-Base-Calculos-de-pH-5-320.jpg)


![Cálculo de pH BASE FUERTE Se disuelven 0,86 g de Ba(OH) 2 en la cantidad de agua necesaria para obtener 0,1 L de disolución. (PAU 5-2004) H + 2 H 2 O (l) + Ba(OH) 2 (ac) -> 2 OH - (ac) + Ba 2+ (ac) la base está totalmente disociada [ Ba(OH) 2 ] o =0,5 M [ OH - ]=2 · 0,5= 0,1 M](https://image.slidesharecdn.com/t6-acido-base-calculos-de-ph-3368/85/T6-Acido-Base-Calculos-de-pH-8-320.jpg)
![Cálculo de pH BASE FUERTE Se disuelven 0,86 g de Ba(OH) 2 en la cantidad de agua necesaria para obtener 0,1 L de disolución. (PAU 5-2004) H + 2 H 2 O (l) + Ba(OH) 2 (ac) 2 OH - (ac) + Ba 2+ (ac) [ OH - ]=2 · 0,5= 1 M 10 -14 =[ H 3 O + ]·[ OH - ] [ H 3 O + ] = 10 -14 M](https://image.slidesharecdn.com/t6-acido-base-calculos-de-ph-3368/85/T6-Acido-Base-Calculos-de-pH-9-320.jpg)
![Cálculo de pH BASE FUERTE Se disuelven 0,86 g de Ba(OH) 2 en la cantidad de agua necesaria para obtener 0,1 L de disolución. (PAU 5-2004) H + 2 H 2 O (l) + Ba(OH) 2 (ac) 2 OH - (ac) + Ba 2+ (ac) [ OH - ]=2 · 0,5= 1 M 10 -14 =[ H 3 O + ]·[ OH - ] [ H 3 O + ] = 10 -14 M pH=14 (muy básico)](https://image.slidesharecdn.com/t6-acido-base-calculos-de-ph-3368/85/T6-Acido-Base-Calculos-de-pH-10-320.jpg)
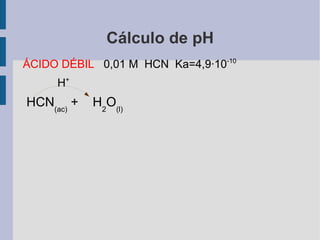
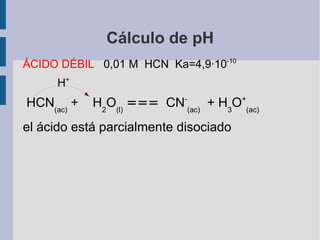

![Cálculo de pH ÁCIDO DÉBIL 0,01 M HCN Ka=4,9·10 -10 H + HCN (ac) + H 2 O (l) === CN - (ac) + H 3 O + (ac) el ácido está parcialmente disociado [H 3 O + ]=2,2·10 -6 M pH= 5,7](https://image.slidesharecdn.com/t6-acido-base-calculos-de-ph-3368/85/T6-Acido-Base-Calculos-de-pH-14-320.jpg)
![Cálculo de pH ÁCIDO DÉBIL 0,01 M HCN Ka=4,9·10 -10 H + HCN (ac) + H 2 O (l) === CN - (ac) + H 3 O + (ac) el ácido está parcialmente disociado [H 3 O + ]=2,2·10 -6 M [CN - ]=2,2·10 -6 M HCN disociado grado de disociación = --------------------- HCN inicial](https://image.slidesharecdn.com/t6-acido-base-calculos-de-ph-3368/85/T6-Acido-Base-Calculos-de-pH-15-320.jpg)
![Cálculo de pH ÁCIDO DÉBIL 0,01 M HCN Ka=4,9·10 -10 H + HCN (ac) + H 2 O (l) === CN - (ac) + H 3 O + (ac) el ácido está parcialmente disociado [H 3 O + ]=2,2·10 -6 M [CN - ]=2,2·10 -6 M 2,2·10 -6 M grado de disociación = ----------------- 0,01 M](https://image.slidesharecdn.com/t6-acido-base-calculos-de-ph-3368/85/T6-Acido-Base-Calculos-de-pH-16-320.jpg)
