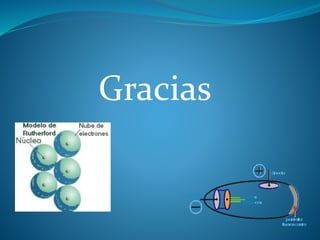
Los átomos son las partículas fundamentales que componen la materia. John Dalton formuló la teoría atómica en 1803, proponiendo que los elementos químicos están compuestos de átomos indivisibles y que los átomos de diferentes elementos se diferencian en su masa. Más tarde, experimentos de J.J. Thomson y Ernest Rutherford revelaron que los átomos están compuestos de un núcleo central rodeado por electrones.