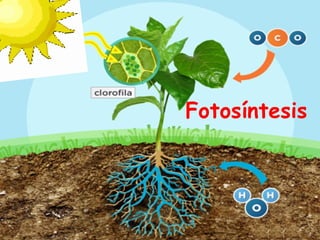
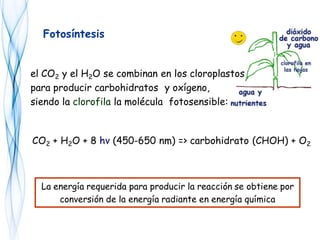
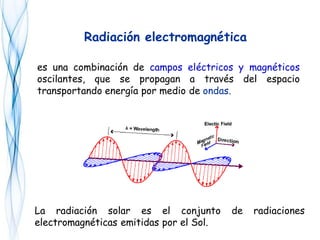
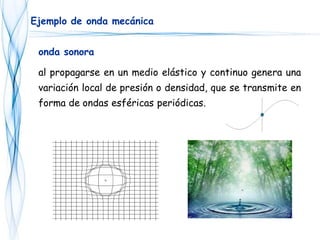
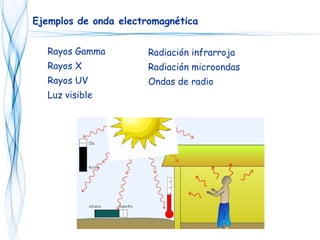
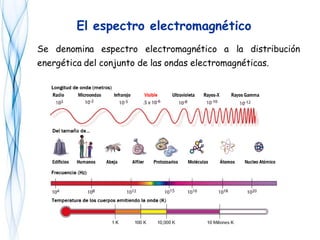
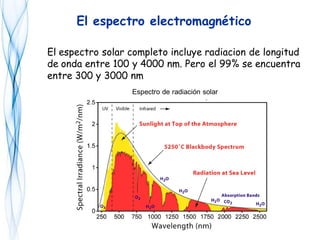
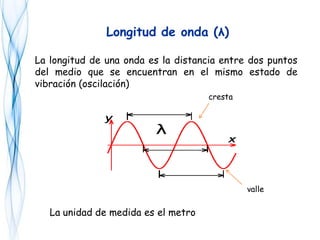
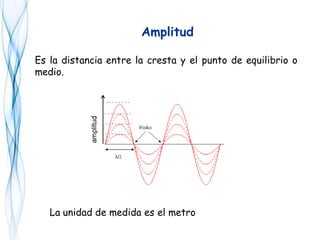
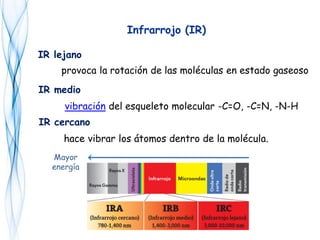
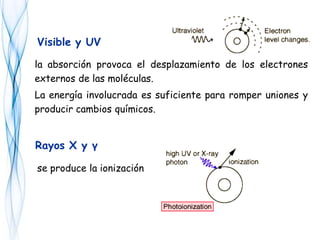
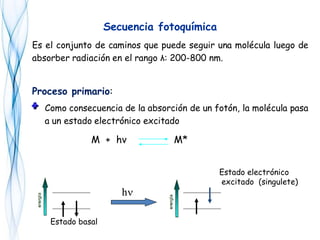
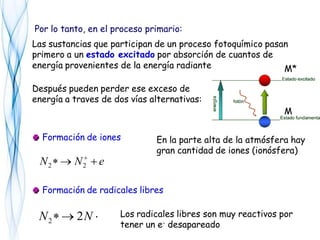
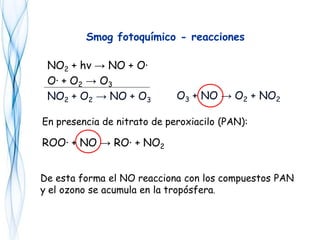
Este documento trata sobre la fotoquímica. Explica el espectro electromagnético, las leyes fundamentales de la fotoquímica, el rendimiento cuántico y ejemplos. También describe el smog fotoquímico, las reacciones fotosensibilizadas y la fotosíntesis.























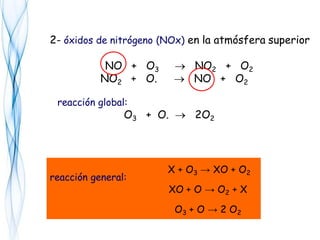
![O2 + hν → O• + O•
2 [O• + O2 → O3 ]
3 O2 + hν → 2 O3
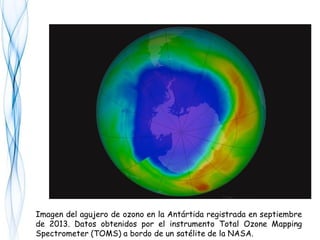
El equilibrio dinámico del ozono
O3 + hν → O2 + O• ΔH = - 90 kJ mol-1
O3 + O• → 2 O2
2 O3 + hν → 3 O2
En la estratósfera, el ozono y el oxígeno absorben la mayor parte
de la radiación de onda corta UV entre los 200 y los 300 nm
La liberación de 90 kJ mol-1 produce una gran cantidad de calor,
por lo cual la estratósfera es más caliente que la capa más exterior
de la troposfera, haciendo que el clima en la tropósfera sea menos
extremo de lo que realmente podría ser.
El ozono se produce mediante la siguiente reacción (λ~250 nm) :](https://image.slidesharecdn.com/fotoqumica-140619102742-phpapp01/85/Fotoquimica-38-320.jpg)