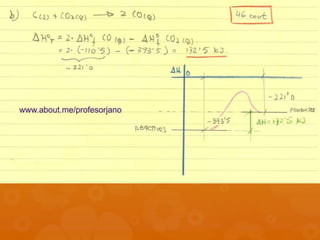
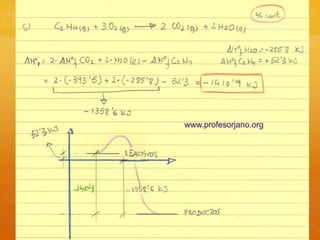
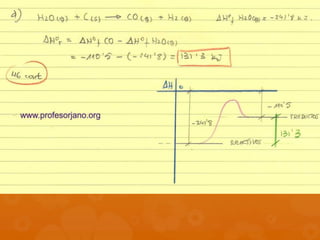
El documento contiene la descripción de varios problemas y ejercicios de termoquímica. Los problemas involucran calcular cantidades de sustancias, variaciones de energía libre y entalpía, y determinar si reacciones son espontáneas basado en datos termoquímicos provistos como calor de combustión, variación de entalpía y entropía.



















![Ejercicio 38
El volframio que se emplea en los filamentos de
lámparas de incandescencia se prepara por
reducción de óxido de volframio (VI), WO3 (g), con
hidrógeno a alta temperatura, según la reacción:
WO3 (s) + 3 H2 (g) W(s) + 3 H2O(g)
Si ΔHof [H2O(g)] = -241’8 kJ.mol-1, calcula cuál es el valor
de la entalpía estándar de formación del WO3.](https://image.slidesharecdn.com/termoqejerciciosclase1-130121121313-phpapp01/85/Termoq-ejercicios-clase-1-23-320.jpg)
