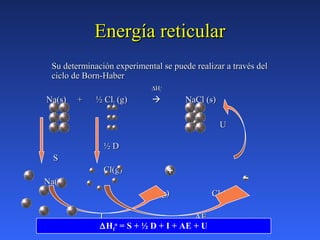
Este documento describe conceptos básicos de termoquímica. Define termoquímica como el estudio del intercambio energético de un sistema químico con el exterior. Explica que algunas reacciones desprenden energía (exotérmicas) mientras que otras la requieren (endotérmicas). También introduce conceptos como entalpía, calor a presión y volumen constantes, y entalpía estándar de formación.

































![Ejemplo:Ejemplo: Sabiendo que las energía de los siguientes enlacesSabiendo que las energía de los siguientes enlaces
(kJ/mol): C=C(kJ/mol): C=C :: 611; C611; C––CC :: 347; C347; C––HH :: 413 y H413 y H––HH :: 436,436,
calcular el valor decalcular el valor de ∆∆HH00
de la reacción de hidrogenación delde la reacción de hidrogenación del
eteno.eteno.
Reacción: CHReacción: CH22=CH=CH22(g) + H(g) + H22(g)(g) →→ CHCH33–CH–CH33(g)(g)
En el proceso se rompe un enlace C=C y otro H–H y se forman 2En el proceso se rompe un enlace C=C y otro H–H y se forman 2
enlaces C–H nuevos (el etano tiene 6 mientras que el eteno teníaenlaces C–H nuevos (el etano tiene 6 mientras que el eteno tenía
sólo 4) y un enlace C–C.sólo 4) y un enlace C–C.
∆∆ HH00
== ΣΣ EEee(enl. rotos) –(enl. rotos) – ΣΣ EEee(enl. formados) =(enl. formados) =
∆∆ HH00
= [1E= [1Eee(C=C) + 1 E(C=C) + 1 Eee(H–H)] – [1E(H–H)] – [1Eee(C–C) + 2 E(C–C) + 2 Eee(C–H)](C–H)]
∆∆ HH00
= 1 mol · 611 kJ/mol + 1mol · 436 kJ/mol= 1 mol · 611 kJ/mol + 1mol · 436 kJ/mol
– (1 mol · 347 kJ/mol + 2 mol · 413 kJ/mol) =– (1 mol · 347 kJ/mol + 2 mol · 413 kJ/mol) = –126 kJ–126 kJ](https://image.slidesharecdn.com/termoquimic-161222000245/85/Termoquimic-35-320.jpg)
![Ejercicio:Ejercicio: Calcula el calor de combustión deCalcula el calor de combustión de
propanopropano a partir de los datos de energíaa partir de los datos de energía
de enlace de la tablade enlace de la tabla..
CC33HH88 + 5 O+ 5 O22 →→ 3 CO3 CO22 + 4 H+ 4 H22OO
Enlaces rotos:Enlaces rotos:
8 C–H, 2 C–C y 5 O=O8 C–H, 2 C–C y 5 O=O
Enlaces formados:Enlaces formados:
6 C=O y 8 O–H6 C=O y 8 O–H
∆∆HH00
== ΣΣ EEee(e. rotos) –(e. rotos) – ΣΣ EEee(e. form.)(e. form.)
∆∆HH00
= [8 E= [8 Eee(C–H) + 2 E(C–H) + 2 Eee(C–C) +(C–C) +
5 E5 Eee(O=O)] – [6 E(O=O)] – [6 Eee(C=O) + 8 E(C=O) + 8 Eee(O–H)](O–H)]
∆∆HH00
= 8·413 kJ + 2·347 kJ +5·499 kJ – (6·745 kJ += 8·413 kJ + 2·347 kJ +5·499 kJ – (6·745 kJ +
8·460 kJ) = –1657 kJ8·460 kJ) = –1657 kJ
∆∆HH00
combcomb(C(C33HH88) =) = –1657 kJ/mol–1657 kJ/mol
EnlaceEnlace EEee (kJ/mol)(kJ/mol)
H–HH–H 436436
C–CC–C 347347
C=CC=C 620620
CC≡≡CC 812812
O=OO=O 499499
Cl–CCl–C 243243
C–HC–H 413413
C–OC–O 315315
C=OC=O 745745
O–HO–H 460460
Cl–HCl–H 432432](https://image.slidesharecdn.com/termoquimic-161222000245/85/Termoquimic-36-320.jpg)














