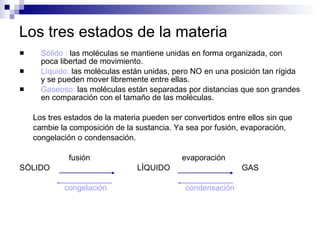
El documento presenta una introducción a la química como ciencia, describiendo sus áreas de aplicación como la salud, energía y ambiente, materiales y tecnología, y alimentos. Explica los conceptos básicos de la química incluyendo la clasificación de la materia, sustancias, mezclas, elementos y compuestos. También cubre temas como átomos, moléculas, estados de la materia, y propiedades físicas y químicas.