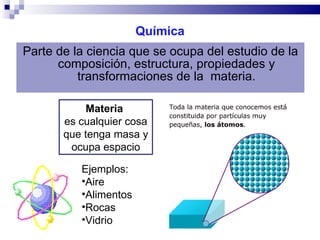
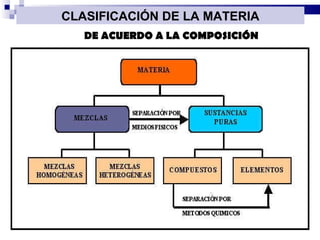
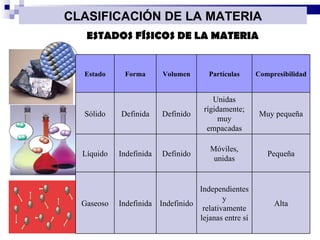
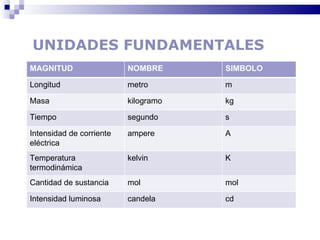
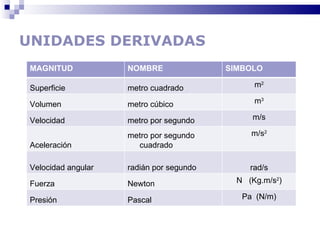
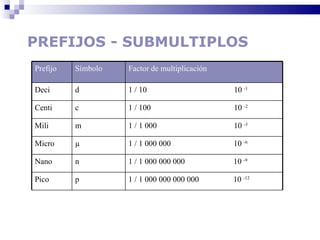
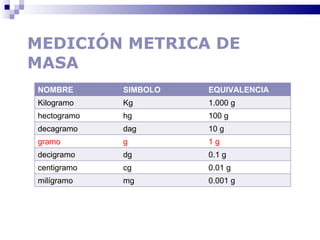
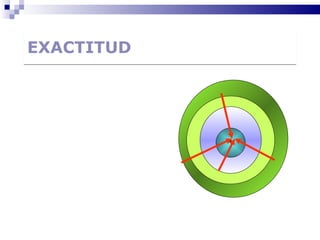
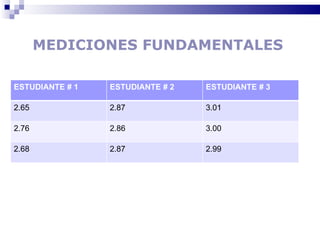
El documento introduce los conceptos básicos de la química, incluyendo las propiedades de la materia, los estados físicos, y las diferencias entre cambios físicos y químicos. Explica las unidades del sistema internacional y cómo medir y expresar cantidades físicas.