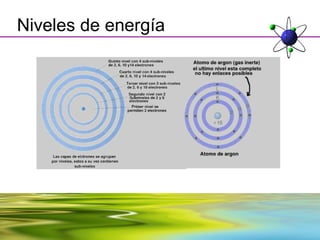
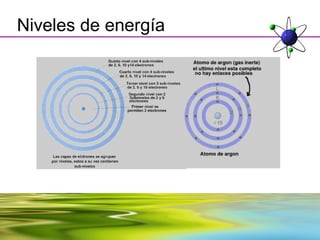
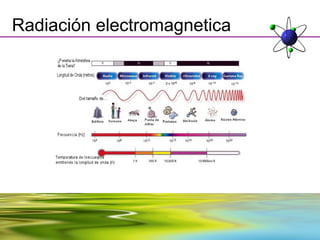
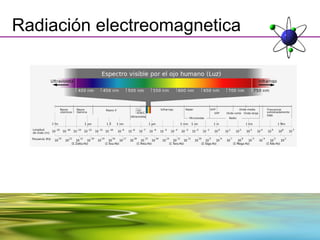
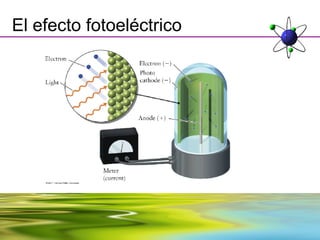
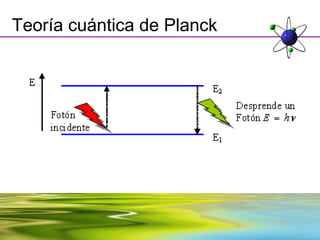
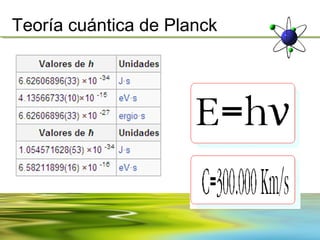
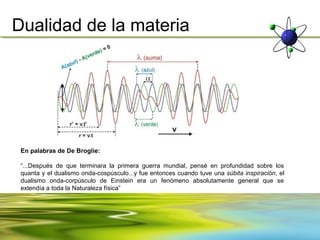
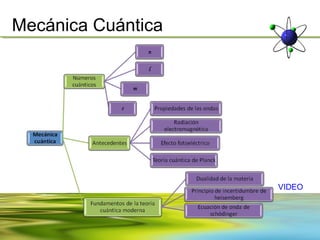
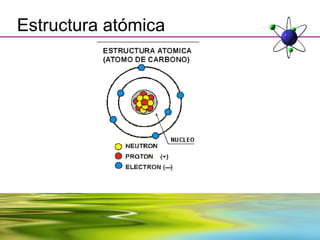
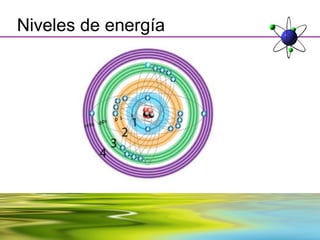
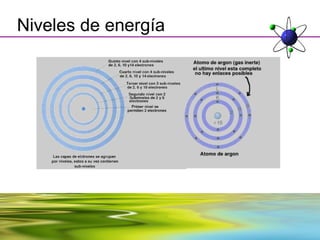
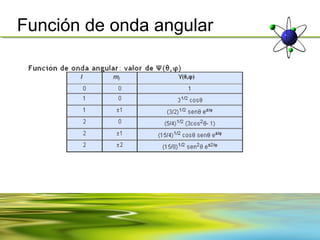
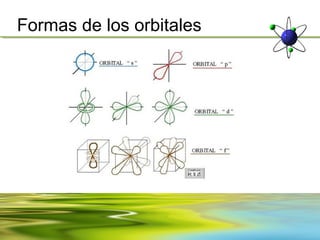
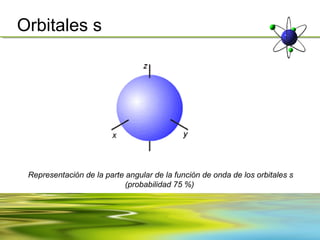
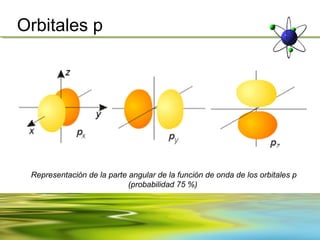
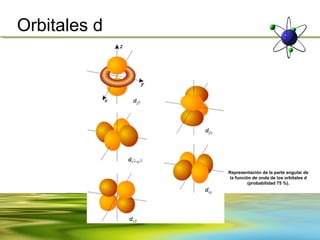
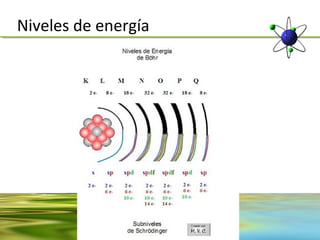
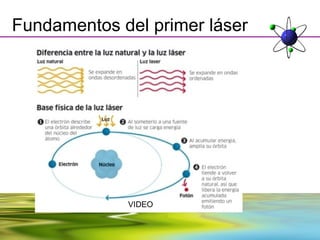
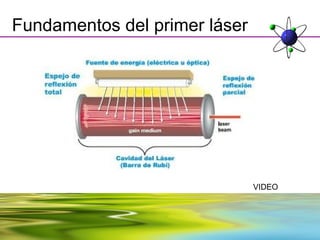
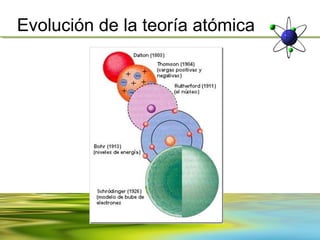
Este documento resume la evolución de la teoría atómica desde la física clásica hasta la mecánica cuántica. Explica las propiedades de las ondas y cómo científicos como Faraday, Maxwell y Planck contribuyeron al desarrollo de la teoría electromagnética y cuántica. También cubre conceptos como los niveles de energía, los números cuánticos, las formas de los orbitales atómicos y ejercicios relacionados con estos temas.


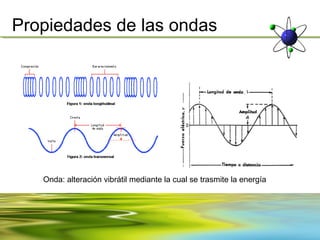
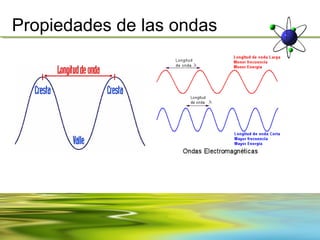

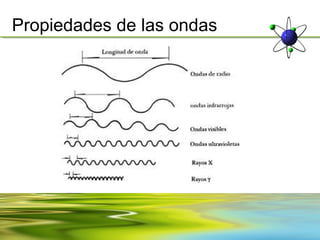
![Propiedades de las ondas
La velocidad es otra de las propiedades importantes de las ondas y del
medio en el cual viaja (por ejemplo: aire, agua o vacio) y es producto de su
longitud y frecuencia.
Distancia Distancia ondas
= =
Tiempo Onda Tiempo
v= λf
v= velocidad [m/s]
λ= longitud de onda [m]
f= frecuencia [Hz] (nu)](https://image.slidesharecdn.com/unidad2-130303164110-phpapp01/85/Unidad-2-7-320.jpg)