Ley de los gases
•Descargar como PPT, PDF•
3 recomendaciones•876 vistas
Denunciar
Compartir
Denunciar
Compartir
Más contenido relacionado
La actualidad más candente
La actualidad más candente (20)
Proyecto integrador. experimentando con las leyes de los gases

Proyecto integrador. experimentando con las leyes de los gases
Similar a Ley de los gases
Similar a Ley de los gases (20)
Leyes de los gases: guía-problemas-animaciones-8ºbásico

Leyes de los gases: guía-problemas-animaciones-8ºbásico
Más de EMMANUEL MENDEZ
Más de EMMANUEL MENDEZ (20)
Plan de ciencias 3 bloque 1 las caracteristicas de los materiales

Plan de ciencias 3 bloque 1 las caracteristicas de los materiales
Plan Ciencias 2 bloque 1 La descripción del movimiento y la fuerza

Plan Ciencias 2 bloque 1 La descripción del movimiento y la fuerza
Ciencias III Bloque 1 Las CaracteríSticas De Los Materiales

Ciencias III Bloque 1 Las CaracteríSticas De Los Materiales
Ciencias II Boloque1 El Movimiento. La Descripción De...

Ciencias II Boloque1 El Movimiento. La Descripción De...
Último
Centros Multigrados Procedimientos para la planificación en los Centros Educativos tipo V ( multi...

Procedimientos para la planificación en los Centros Educativos tipo V ( multi...Katherine Concepcion Gonzalez
Último (20)
PLAN LECTOR 2024 integrado nivel inicial-miercoles 10.pptx

PLAN LECTOR 2024 integrado nivel inicial-miercoles 10.pptx
PINTURA DEL RENACIMIENTO EN ESPAÑA (SIGLO XVI).ppt

PINTURA DEL RENACIMIENTO EN ESPAÑA (SIGLO XVI).ppt
PP_Comunicacion en Salud: Objetivación de signos y síntomas

PP_Comunicacion en Salud: Objetivación de signos y síntomas
Procedimientos para la planificación en los Centros Educativos tipo V ( multi...

Procedimientos para la planificación en los Centros Educativos tipo V ( multi...
Tema 19. Inmunología y el sistema inmunitario 2024

Tema 19. Inmunología y el sistema inmunitario 2024
Novena de Pentecostés con textos de san Juan Eudes

Novena de Pentecostés con textos de san Juan Eudes
RESOLUCIÓN VICEMINISTERIAL 00048 - 2024 EVALUACION

RESOLUCIÓN VICEMINISTERIAL 00048 - 2024 EVALUACION
Los avatares para el juego dramático en entornos virtuales

Los avatares para el juego dramático en entornos virtuales
Tema 10. Dinámica y funciones de la Atmosfera 2024

Tema 10. Dinámica y funciones de la Atmosfera 2024
Ley de los gases
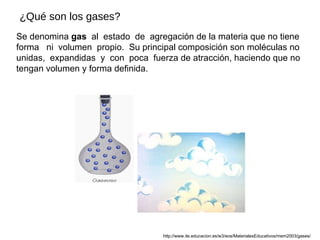
- 1. Se denomina gas al estado de agregación de la materia que no tiene forma ni volumen propio. Su principal composición son moléculas no unidas, expandidas y con poca fuerza de atracción, haciendo que no tengan volumen y forma definida. ¿Qué son los gases? http://www.ite.educacion.es/w3/eos/MaterialesEducativos/mem2003/gases/
- 2. Leyes de los gases LEY DE BOYLE “ Relación entre la presión y el volumen de un gas cuando la temperatura es constante” El químico y físico Robert Boyle en el siglo XVII estudió los procesos isotérmicos y después de realizar varios experimentos en los que midió diversos valores de presión (p) y sus correspondientes valores de volumen (v) concluyó que: al duplicar la presión, el volumen queda dividido entre 2 al triplicar la presión, el volumen queda dividido entre 3, etc…
- 3. Por ejemplo: Si se parte del estado inicial y se aumenta gradualmente la presión, tendremos que : Estado 1: p 1 = 1 atm y V 1 = 600 cm 3 Estado 2: p 2 = 2 atm y V2 = 300 cm 3 Estado 3: p3= 3 atm y V 3 = 200 cm 3 Este resultado fue corroborado por aquel científico y se conoce como Ley de Boyle.
- 4. Ley de Boyle La presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante. Méndez
- 5. LEY DE CHARLES Y GAY LUSSAC “ Relación entre la temperatura y el volumen de un gas cuando la presión es constante” Las transformaciones isobáricas de un gas las estudio el científico Gay Lussac en el siglo XVIII, dando continuidad al trabajo anterior de su colega J. Charles. Estos científicos analizaron experimentalmente la dilatación térmica de una masa gaseosa a presión constante. Gay Lussac J. Charles
- 7. Estas conclusiones pueden ser sintetizadas en el siguiente enunciado conocido como ley de Charles y Gay Lussac. Ley de Charles y Gay Lussac Si la presión de una masa gaseosa se mantiene constante, su volumen varia en proporción directa a su temperatura. Méndez
